
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вказівки до виконання роботи. Контрольні запитання
|
|
|
|
Лабораторна робота № 2.4. Визначення Cp/CV для повітря методом Клемана – Дезорма
Контрольні запитання
1. Що вважають ідеальним газом?
2. У чому полягають мікроскопічні та макроскопічні параметри ідеального газу?
3. Запишіть рівняння Клапейрона – Менделєєва.
4. Напишіть рівняння ізопроцесів та відтворити їхнє графічне зображення.
5. Запишіть перше начало термодинаміки та застосувати його для ізо-процесів.
6. Дайте визначення фізичного змісту універсальної газової сталої.
7. Виведіть формулу Майєра та поясніть її фізичний зміст.
8. Дайте визначення питомої та молярної теплоємності.
9. Наведіть приклади ізопроцесів в природі.
10. У яких галузях науки і техніки використовують газові процеси?
Мета роботи: дослідити ізопроцеси в газах, теплоємність газів; експериментальним шляхом визначити відношення Сp / СV для повітря і порівняти отримані дані із значеннями, розрахованими теоретично.
Для виконання роботи потрібно засвоїти такий теоретичний матеріал: внутрішня енергія газу; теплота та робота; перше начало термодинаміки; застосування першого начала термодинаміки до ізопроцесів; залежність теплоємності ідеального газу від виду процесу; адіабатичний процес; рівняння адіабати.
Література: [ 3, §50-55; 4, т.1 §83, 87, 90; 6, §§ 4.3, 4.6, 4.7; 5.3.2;
7, § 2.3].
Перед виконанням ознайомитись з вказівками до роботи № 2.3.
Стан деякої маси газу визначається трьома термодинамічними параметрами: тиском р, об’ємом V і температурою Т.
Рівняння, що пов’язують ці параметри, називаються рівняннями стану. Для ідеальних газів таким рівнянням є рівняння Менделєєва – Клапейрона:
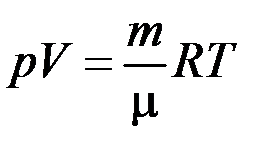 , (2.4.1)
, (2.4.1)
де m – маса газу, 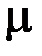 – молярна маса, R – універсальна газова стала.
– молярна маса, R – універсальна газова стала.
|
|
|
Одним з процесів, які можуть відбуватися в газах, є адіабатичний процес. Адіабатичний процес – це термодинамічний процес, який відбувається без теплообміну з навколишнім середовищем. У такому випадку термодинамічна система не отримує теплоти ззовні і не віддає теплоти назовні.
Перше начало термодинаміки:
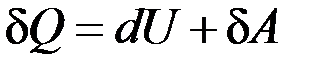 . (2.4.2)
. (2.4.2)
Оскільки для адіабатичного процесу δQ = 0, то з рівняння (2.4.2):
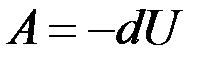 .
.
Тобто в адіабатичному процесі робота виконується за рахунок зменшення внутрішньої енергії термодинамічної системи.
В адіабатичному процесі, на відміну від ізопроцесів, змінюються всі три параметри – р, V, Т.
Використовуючи рівняння стану (2.4.1) та перше начало термодинаміки (2.4.2), можна отримати рівняння для адіабатичного процесу, які мають назву рівняння Пуассона:
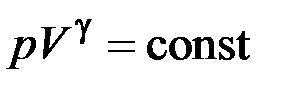 ;
; 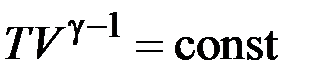 ;
; 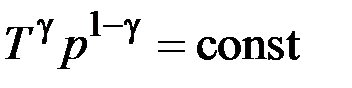 . (2.4.3)
. (2.4.3)
У рівняннях (2.4.3) 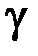 – коефіцієнт Пуассона, який визначають так:
– коефіцієнт Пуассона, який визначають так:
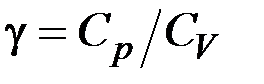 , (2.4.4)
, (2.4.4)
де  і
і  – молярні теплоємності за постійного тиску і об’єму відповідно.
– молярні теплоємності за постійного тиску і об’єму відповідно.
Із кінетичної теорії газів випливає, що 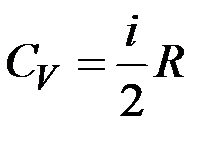 ,
, 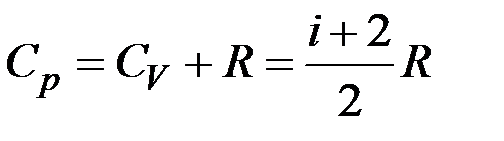 , де i – число степенів свободи, котре показує кількість незалежних рухів, які молекула ідеального газу здатна здійснити в просторі; i = 3 – для одноатомного газу, i = 5 – для двоатомного газу, i = 6 – для три- та багатоатомного газу (в даному випадку не враховуються коливальні степені вільності).
, де i – число степенів свободи, котре показує кількість незалежних рухів, які молекула ідеального газу здатна здійснити в просторі; i = 3 – для одноатомного газу, i = 5 – для двоатомного газу, i = 6 – для три- та багатоатомного газу (в даному випадку не враховуються коливальні степені вільності).
Тоді:
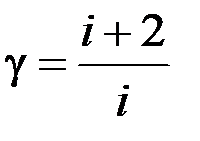 . (2.4.5)
. (2.4.5)
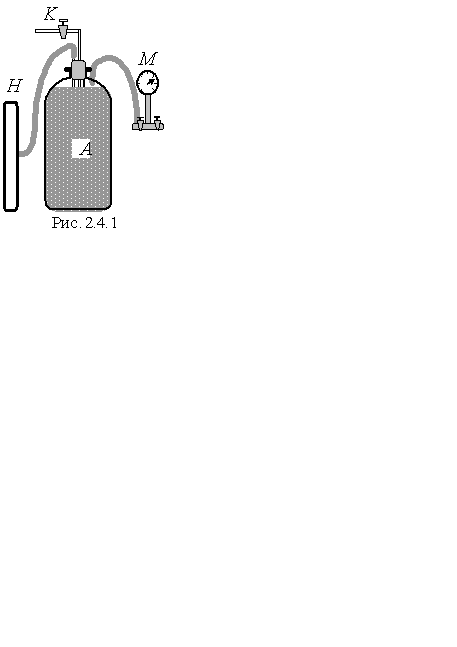 Одним з найпростіших методів визначення відношення Cp / CV є метод Клемана і Дезорма, що ґрунтується на застосуванні адіабатичного процесу.
Одним з найпростіших методів визначення відношення Cp / CV є метод Клемана і Дезорма, що ґрунтується на застосуванні адіабатичного процесу.
Експериментальна установка (рис. 2.4.1) складається зі скляного балона А (ємністю 20 л), який за допомогою двох вакуумних гумових трубок з’єднується з манометром (М) та насосом (Н). Насос через пасову передачу сполучено з електричним двигуном. Кран (К) дає змогу з’єднувати балон з атмосферою.
Надлишковий, порівняно з атмосферним, тиск повітря (Δ р) в балоні (А) вимірюється манометром, сполученим з гумовою трубкою вхідним краном.
Опишемо експеримент і покажемо термодинамічні процеси на діаграмі стану газу в параметрах (pV) (рис. 2.4.2).
|
|
|
За допомогою насоса накачаємо в балон деяку кількість повітря. Під час накачування повітря виконується певна робота, що викликає підвищення температури повітря в балоні. Зупинивши накачування, чекаємо деякий час, щоб дати можливість повітрю в балоні охолодитися до температури навколишнього середовища T 1. Тиск накачаного повітря при цьому дорівнює р 1, тобто є вищим за атмосферний тиск р 0 (рис. 2.4.2). Будемо вважати цей стан першим: (р 1, V 1, T 1).
Відкрутимо кран К, що сполучає балон А з атмосферою (рис. 2.4.1). Тиск газу починає зрівнюватися з атмосферним, а його температура спочатку дещо знизиться через швидке розширення, а потім знову почне наближатися до кімнатної.
Якщо теплопровідність стінок балона є малою (скло має низький коефіцієнт теплопровідності), а отвір крана К достатньо великим, вирівнювання тиску відбувається значно швидше, ніж вирівнювання температури, тобто:  , (2.4.6)
, (2.4.6)
де 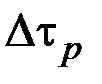 ,
, 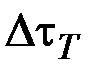 – відповідно час вирівнювання тиску та температури.
– відповідно час вирівнювання тиску та температури.
Нехай кран К був відкритий протягом такого проміжку часу 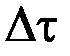 , що:
, що:
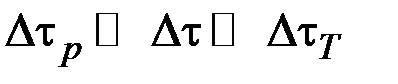 . (2.4.7)
. (2.4.7)
У цьому випадку теплообміном, що відбувається за час 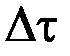 через стінки балона, можна знехтувати і процес розширення вважати адіабатичним. Газ перейде до стану 2 з параметрами (р 2, V 2, T 2).
через стінки балона, можна знехтувати і процес розширення вважати адіабатичним. Газ перейде до стану 2 з параметрами (р 2, V 2, T 2).
З рівняння адіабатичного процесу (2.4.3) знайдемо:
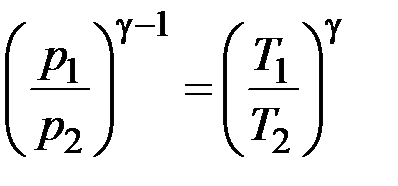 . (2.4.8)
. (2.4.8)
Відмітимо, що наприкінці адіабатичного розширення тиск 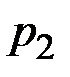 дорівнює атмосферному тиску
дорівнює атмосферному тиску 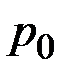 , а температура Т 2 виявляється дещо нижчою за кімнатну температуру Т 1 (температура газу знижується, оскільки робота розширення виконується за рахунок зменшення внутрішньої енергії газу).
, а температура Т 2 виявляється дещо нижчою за кімнатну температуру Т 1 (температура газу знижується, оскільки робота розширення виконується за рахунок зменшення внутрішньої енергії газу).
Після того як краном К знову від’єднаємо балон від атмосфери, почнеться повільне ізохоричне нагрівання газу зі швидкістю, що визначається теплопровідністю скляних стінок. Разом із підвищенням температури зростає і тиск газу. За час 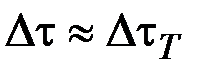 система досягає рівноваги, і температура Т 3, що встановлюється, стає однаковою з кімнатною температурою Т 1. Газ перейде до стану 3 з параметрами (р 3, V 2, T 1).
система досягає рівноваги, і температура Т 3, що встановлюється, стає однаковою з кімнатною температурою Т 1. Газ перейде до стану 3 з параметрами (р 3, V 2, T 1).
Процес вирівнювання температури за закритого крану підлягає закону Гей-Люссака:
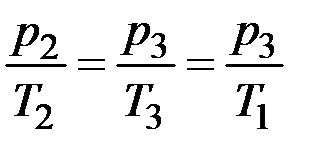 . (2.4.9)
. (2.4.9)
Вилучаючи за допомогою формули (2.4.9) відношення температур Т 1/ Т 2 з рівняння (2.4.8), знайдемо:
|
|
|
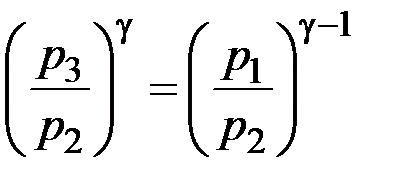 . (2.4.10).
. (2.4.10).
Розв’яжемо це рівняння (2.4.10) відносно γ:
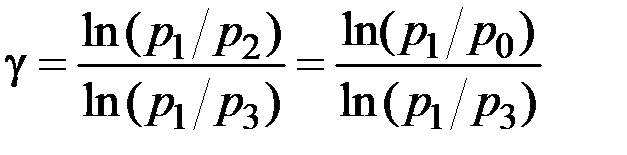 . (2.4.11)
. (2.4.11)
У нашого випадку значення тиску р 1 та р 3 мало відрізняються від р 0, тож формулу (2.4.11) можна суттєво спростити. Введемо позначення:
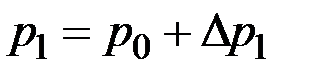 ,
, 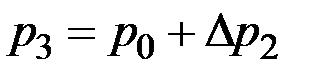 . (2.4.12)
. (2.4.12)
Враховуючи (2.4.12) та розкладаючи логарифмічну функцію (2.4.11) в ряд Тейлора і нехтуючи членами другого порядку малості, отримаємо:
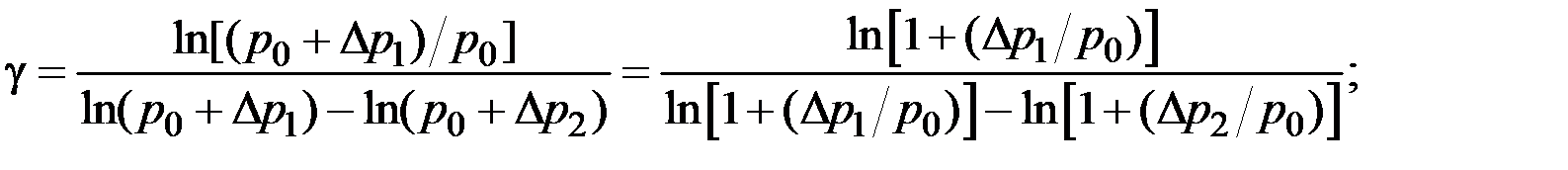
або  . (2.4.13)
. (2.4.13)
Як видно з формули (2.4.13), для визначення відношення молярних теплоємностей 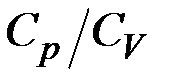 треба знати надлишковий (над атмосферним) тиск в балоні до адіабатичного розширення газу та його надлишковий тиск після ізохоричного нагрівання.
треба знати надлишковий (над атмосферним) тиск в балоні до адіабатичного розширення газу та його надлишковий тиск після ізохоричного нагрівання.
Варто наголосити, що обидві величини слід вимірювати в стані термодинамічної рівноваги, тобто після закінчення теплообміну.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 584; Нарушение авторских прав?; Мы поможем в написании вашей работы!