
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Експериментальна частина
|
|
|
|
Висолювання білків
У водному розчині білкові молекули заряджені і гідратовані, що забезпечує стійкість білкових розчинів. При високій концентрації солей, йони яких теж, гідратовані, відбувається руйнування водних оболонок білкових молекул. Крім того, йони солей адсорбуються на поверхні білкової молекули, внаслідок чого зменшується заряд молекули білка, частинки білка менше відштовхуються, злипаються, випадають в осад.
Амоній сульфат має різко виражену висолюючу здатність і осаджує білки в нейтральному середовищі, а ще краще – у слабо кислому. Інші солі, наприклад натрій хлорид, осаджують білки лише при підкисненні розчину.
Для висолювання різних білків потрібна різна концентрація одних і тих же солей. Отже, білки можна висолювати фракційно. Так, глобуліни випадають в осад при напівнасичені розчину амоній сульфатом, а альбуміни осаджуються при повному насиченні.
Хід процесів висолювання білків
Наливають у пробірку 1,5-2,0 см3 розчину білка, додають рівний об’єм насиченого розчину амоній сульфату і струшують суміш. З’являється помутніння від утвореного осаду глобулінів. Слід звернути увагу на те, щоб розчин амоній сульфату був дійсно насичений, тобто на дні посудини з розчином був осад.
Мутну рідину фільтрують крізь складчастий фільтр. Частину прозорого фільтрату нагрівають до кипіння і спостерігають згортання альбумінів, що знаходились у розчині. До іншої частини фільтрату додають при перемішуванні надлишок амоній сульфату у вигляді порошку до припинення його розчинення. З’являється помутніння, альбуміни випадають в осад.
Осадження білків солями лужних металів і амонію є оборотним процесом. При додаванні води білки знову розчиняються.
|
|
|
Згортання білків при нагріванні
У п’ять пробірок наливають по 2 см3 розчину білка.
1. Нагрівають вміст першої пробірки. Осад білка з'являється ще до того, як рідина закипить.
2. Додають до другої пробірки одну краплину розчину ацетатної кислоти (w =1%) і нагрівають. Осад випадає швидше внаслідок того, що при підкисненні рН розчину наближається до ізоелектричної точки білка.
3. У третю пробірку додають близько 0,5 см3 розчину ацетатної кислоти (w =10%) і нагрівають. Осад білка не утворюється навіть при кип’ятінні.
У даному випадку надлишок ацетатної кислоти призводить до перезарядки молекул білка, молекули отримують позитивний заряд, взаємно відштовхуються, і осад не утворюється.
4. У четверту пробірку додають 0,5 см3 розчину ацетатної кислоти (w =10%), декілька крапель насиченого розчину натрій хлориду і нагрівають. Утворюється осад білка.
5. У п'яту пробірку вносять близько 0,5 см3 розчину натрій гідроксиду і нагрівають. Осад білка не утворюється навіть при кипінні.
Причина полягає в тому, що досліджуваний білок кислий і молекули його мають заряд (-), а рІ <7,0. Якщо рН середовища більше від значення ізоелектричної точки білка, то білкові молекули матимуть негативний заряд (-). Отже, лужне середовище буде перешкоджати досягненню кислим білком ізоелектричного стану (рН <7,0), і білок не випадатиме в осад.
Сильно кисле середовище теж стимулюватиме досягнення білком ізоелетричного стану, особливо для основних білків, у яких рІ >7,0.
Білки як амфотерні електроліти дисоціюють як кислоти і як основи. У водному середовищі, особливо поблизу ізоелектричної точки, молекули білка є біполярними йонами:
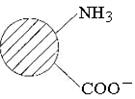
У кислому середовищі зменшується дисоціація білка по карбоксильних групах, молекула отримує позитивний заряд і знаходиться в розчині навіть при кип’ятінні.
У лужному середовищі зменшується протонізація аміногруп білка, молекули отримують негативний заряд і залишаються у розчині навіть при кип’ятінні.
|
|
|
Додавання до розчину білка нейтральних солей полегшує і прискорює згортання білків при кип’ятінні внаслідок дегідратації. Згортання білків при нагріванні відбувається внаслідок їх денатурації – порушення четвертинної, третинної, вторинної структури молекул – і є процесом практично незворотним.
Осадження білків концентрованими мінеральними кислотами
У три пробірки наливають по 1-2 см3 концентрованих нітратної, сульфатної і хлоридної кислот. Потім, нахиливши кожну пробірку, по стінці доливають до неї з піпетки по 0,5 см3 досліджуваного розчину білка так, щоб він не змішувався з кислотою. На межі двох рідин з’являється білий аморфний осад білка. При струшуванні осад, що утворився при дії хлоридної і сульфатної кислот, розчиняється у їх надлишку. Розчинення осаду білка у надлишку хлоридної кислоти пояснюється тим, що відбувається перезарядка білкової молекули і перехід із ізоелектричного стану (при рН<рІ) у стан з позитивним зарядом білкової молекули.
Збільшення осаду білка в надлишку нітратної кислоти відбувається внаслідок процесів нітрування ароматичних амінокислот білка і зшивання поліпептидних ланцюгів за рахунок продуктів реакції. У надлишку концентрованої сульфатної кислоти руйнуються молекули білка до найпростіших низькомолекулярних сполук, які не дають осаду.
Осадження білків органічними кислотами
У дві пробірки наливають по 2-3 см3 розчину білка і додають в одну з них декілька крапель розчину трихлорацетатної кислоти (w =5%), у другу – декілька крапель розчину сульфосаліцилової кислоти (w =20%). В обох випадках випадають осади білка.
Сульфосаліцилова і трихлорацетатна кислоти є чутливими й специфічними реактивами на білок. Трихлорацетатна кислота осаджує тільки білки і не осаджує продуктів розкладу білка і амінокислот, її використовують для повного вилучення білків з біологічних рідин.
Осадження білків солями важких металів
У дві пробірки наливають по 1-2 см3 досліджуваного розчину білка і повільно, краплинами при струшуванні додають в одну з них розчин купрум(ІІ) сульфату, а в іншу – розчин плюмбум(ІІ) ацетату. Випадають пластівчасті осади із сіллю Купруму – блакитного кольору, із сіллю Плюмбуму – білого кольору.
|
|
|
Солі важких металів необоротно осаджують білки внаслідок зшивання поліпептидних ланцюгів багатовалентними атомами металів. Тому білки застосовують при отруєнні солями важких металів. Деякі з таких осадів (наприклад, із солями Купруму, Плюмбуму, Цинку) розчиняються у надлишку солі внаслідок адсорбції йонів цих металів на поверхні білкових частинок, у результаті цього білкові частинки набувають заряду і переходять у розчин.
Розчинення осадів денатурованих білків у надлишку солі важких металів називається адсорбційною пептизацією. Такі явища вивчає колоїдна хімія.
Осадження білків фенолом і формальдегідом
У дві пробірки вносять по 1-2 см3 розчину білка, додають: у першу – рівний об’єм насиченого водного розчину фенолу, а в другу – рівний об’єм розчину формальдегіду (w =40%). В обох пробірках випадає осад білка. Утворення осаду при дії на білок формальдегіду пояснюється взаємодією його з ароматичними амінокислотами білка з утворенням нерозчинних сполук типу феноло-формальдегідних смол.
Осадження білків спиртом
У пробірку наливають 1-1,5 см3 розчину білка і додають трохи кристалічного натрій хлориду. Доливають поступово 5-6 см3 етилового спирту. Випадає пластинчастий осад білка внаслідок дегідратації молекул при додаванні спирту.
Осадження білків натрій вольфраматом
До 3 см3 розчину білка додають 0,5 см3 розчину сульфатної кислоти (С(1/2) = 0,66 моль/дм3) і після перемішування 0,5 см3 розчину натрій вольфрамату (w =10%). Випадає осад. Натрій вольфрамат дуже добре осаджує білки і часто застосовується для вилучення їх з біологічних рідин і екстрактів.
Контрольні завдання
Білкова частина вірусу тютюнової мозаїки складається з 2130 субодиниць, молекулярна маса – 17500. Розрахуйте загальну довжину всіх поліпептидних ланцюгів, якщо частка спіральної конфігурації в них дорівнює 30%.
ЛАБОРАТОРНА РОБОТА № 12
ВИЗНАЧЕННЯ ВІДНОСНОЇ МОЛЕКУЛЯРНОЇ МАСИ АМІНОКИСЛОТ ЗА АМІННИМ НІТРОГЕНОМ
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 811; Нарушение авторских прав?; Мы поможем в написании вашей работы!