
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Конверсия оксида углерода
|
|
|
|
Конверсия метана кислородом воздуха
Процесс неполного окисления метана кислородом (и воздухом) описывается следующими реакциями:
CH4+0,5O2 ⇄ CO+2H2-∆H ∆H=35 кДж (6.1)
CH4+2O2 ⇄ CO2+2H2O-∆H H=891 кДж (6.2)
CH4+H2O ⇄ CO+3H2+∆H H=206 кДж (6.3)
CH4+CO2 ⇄ 2CO+2H2+∆H H=248 кДж (6.4)
Значения констант равновесия первых двух реакций настолько велики (так,Кр реакции 6.1., 6.2 превышает 1011), что эти реакции можно считать практически необратимыми.
Так как все эти реакции протекают с увеличением объема, кислородная и воздушная конверсия подчиняется тем же закономерностям, что и паровая конверсия. В связи с этим повышение концентрации кислорода в газовой смеси сверх стехиометрического не приводит к увеличению выхода продукта.
Повышение давления при конверсии кислородом, как и при конверсии водяным паром, термодинамически нецелесообразно; чтобы при повышенных давлениях добиться высокой степени превращения метана, необходимо проводить процесс при более высоких температурах.
Её проводят при температуре около 9000 С, в избытке окислителя, под давлением и на аналогичном по составу никелевом катализаторе.
Рассмотренные процессы конверсии метана водяным паром и кислородом протекают с различным тепловым эффектом: реакции паровой конверсии эндотермические, требуют подвода теплоты; реакции кислородной конверсии экзотермические, причем выделяющейся теплоты достаточно не только для автотермического осуществления собственно кислородной конверсии, но и для покрытия расхода теплоты на эндотермические реакции паровой конверсии. Поэтому конверсию метана целесообразно проводить со смесью окислителей.
Конверсия оксида углерода проводится с водяным паром и представляет обратимую экзотермическую реакцию:
|
|
|
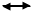 |
CO+H2O CO2+H2-∆H ∆H=41 кДж
Реакция конверсии оксида углерода частично осуществляется уже на стадии паровой конверсии СН4, однако степень превращения СО при этом очень мала и в выходящем газе содержится 11-12% СО.
В отличие от реакций конверсии метана эта реакция протекает без изменения объёма, поэтому повышение давления не влияет на состояние системы, но ускоряет реакцию. Равновесная степень превращения оксида углерода х * возрастает с увеличением отношения H2O: CO и снижается при повышении температуры. На практике отношение H2O: CO поддерживается около 4:1.
Проведение процесса при низких температурах – рациональный путь повышения равновесной степени превращения оксида углерода, но возможный только при наличии высоактивных катализаторов. Следует отметить, что нижний температурный предел процесса ограничен условиями конденсации водяного пара. В случае проведения процесса под давлением 2-3 МПа этот предел составляет 180-2000С. Снижение температуры ниже точки росы вызывает конденсацию влаги на катализаторе, что нежелательно.
Реакция конверсии СО сопровождается значительным выделением теплоты, что обусловило проведение процесса в две стадии при разных температурных режимах на каждой. На первой стадии высокой температурой обеспечивается высокая скорость конверсии большого количества оксида углерода; на второй стадии при пониженной температуре достигается высокая степень конверсии оставшегося СО. Теплота экзотермической реакции используется для получения пара. Таким образом, нужная степень конверсии достигается при одновременном сокращении расхода пара.
Температурный режим на каждой стадии конверсии определяется свойствами применяемых катализаторов. На первой стадии используется железохромовый катализатор, который выпускается в таблетированном и формованном видах. Железохромовый промотированный оксидами калия и кальция катализатор состава (Fe2O3+Cr2O3+K2O+CaO) является высокотемпературным катализатором и обеспечивает необходимую скорость конверсии только при 450-5000С; при этом в конвертированном газе остается до 4% СО.
|
|
|
Для железохромового катализатора ядами являются сернистые соединения. Сероводород реагирует с Fe3O4, образуя сульфид железа FeS. Органические сернистые соединения в присутствии железохромового катализатора взаимодействуют с водяным паром с образованием сероводорода. Помимо сернистых соединений отравляющее действие на железохромовый катализатор оказывают соединения, фосфора, бора, кремния, хлора.
На второй ступени конверсии используется цинкхроммедный катализатор состава (ZnO+Cr2O3+CuO) который работает при 200-3000С и позволяет довести содержание СО в газе до 0,2%. В качестве добавок к указанным выше компонентам применяются соединения магния, титана, палладия, марганца, кобальта и др. Содержание меди в катализаторах колеблется от 20 до 50% (в пересчете на оксид). Наличие в низкотемпературных катализаторах соединений алюминия, магния, марганца сильно повышает их стабильность, делает более устойчивыми к повышению температуры.
Перед эксплуатацией низкотемпературный катализатор восстанавливают оксидом углерода или водородом. При этом формируется его активная поверхность. Оксид меди и другие соединения меди восстанавливаются с образованием мелкодисперстной металлической меди, что, по мнению многих исследователей, и обусловливает его каталитическую активность.
Срок службы низкотемпературных катализаторов обычно не превышает двух лет. Одной из причин их дезактивации является рекристаллизация под действием температуры и реакционной среды. При конденсации влаги на катализаторе происходит снижение его механической прочности и активности. Потеря механической прочности сопровождается разрушением катализатора и ростом гидравлического сопротивления реактора. Соединения серы, хлора а также ненасыщенные углеводороды и аммиак вызывают отравление низкотемпературных катализаторов. Концентрация сероводорода не должна превышать 0,5мг/м3 исходного газа.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 4774; Нарушение авторских прав?; Мы поможем в написании вашей работы!