
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Функции белков
|
|
|
|
Благодаря сложности, разнообразию форм и состава, белки играют важную роль в жизнедеятельности клетки и организма в целом. Функции их разнообразны.
| Функция | Примеры и пояснения |
| 1. Строительная | Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. |
| 2. Транспортная | Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно. |
| 3. Регуляторная | Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов. |
| 4. Защитная | В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений |
| 5. Двигательная | Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных |
| 6. Сигнальная | В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку. |
| 7. Запасающая | В организме животных белки как правило не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется в организме, образуя комплекс с белком ферритином. |
| 8. Энергетическая | При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы. |
| 9. Каталитическая | Одна из важнейших функций белков. Обеспечивается белками - ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобисфосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. |
|
|
|
Ферменты или энзимы – особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз (а иногда и в миллионы) выше скорости реакций, идущих с участием неорганических катализаторов. Вещество, на которое оказывает свое действие фермент, называют субстратом.
Ферменты – глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные. Простые ферменты являются простыми белками, т.е. состоят только из аминокислот. Сложные ферменты являются сложными белками, т.е. в их состав помимо белковой части входит группа небелковой природы — кофактор. У некоторых ферментов в качестве кофакторов выступают витамины. В молекуле фермента выделяют особую часть, называемую активным центром. Активный центр – небольшой участок фермента (от трех до двенадцати аминокислотных остатков), именно в котором происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции. Некоторые ферменты имеют (кроме активного) аллостерические центры – участки, к которым присоединяются регуляторы скорости работы фермента (аллостерические ферменты).
|
|
|
Для реакций ферментативного катализа
|
Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э.Фишера (1890) и Д.Кошланда (1959). Э.Фишер (гипотеза «ключ-замок») предположил, что пространственные конфигурации активного центра фермента и субстрата должны точно соответствовать друг другу. Субстрат сравнивается с "ключом", фермент – с «замком».
Д.Кошланд (гипотеза «рука-перчатка») предположил, что пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу еще называют гипотезой индуцированного соответствия.
Большинство неорганических катализаторов ускоряют химические реакции при очень высоких температурах, имеют максимальную эффективность в сильнокислой или сильнощелочной среде, при высоких давлениях, а большинство ферментов активны при температурах 35-45˚С, физиологических значениях кислотности раствора и при нормальном атмосферном давлении; скорость ферментативных реакций в десятки тысяч (а иногда и в миллионы раз) выше скорости реакций, идущих с участием неорганических катализаторов. Например, пероксид водорода без катализаторов разлагается медленно: 2Н2О2 → 2Н2О + О2. В присутствии солей железа (катализатора) эта реакция идет несколько быстрее. Фермент каталаза (М=252000) за 1 сек. расщепляет 100 тыс. молекул Н2О2 (М=34). Известно более 2000 различных ферментов, представленных белками с высокой молекулярной массой.
Скорость ферментативных реакций зависит от 1) температуры, 2) концентрации фермента, 3) коцентрации субстрата, 4) рН. Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях.
|
|
|
|
При увеличении количества молекул субстрата скорость ферментативной реакции растет до тех пор, пока не произойдет насыщение активных центров фермента – если активный центр каталазы расщепляет в секунду 100 000 молекул субстрата, то при количестве молекул субстрата более 100 000 на активный центр скорость реакции не возрастет.
Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.
Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность (пепсин – 2,0, амилаза слюны – 6,8, липаза поджелудочной железы – 9,0). При более высоких или низких значениях рН активность фермента снижается. При резких сдвигах рН фермент денатурирует.
|
Классификация ферментов. По типу катализируемых химических превращений ферменты разделены на 6 классов: 1) оксиредуктазы (перенос атомов водорода, кислорода или электронов от одного вещества к другому – дегидрогеназа), 2) трансферазы (перенос метильной, ацильной, фосфатной или аминогруппы от одного вещества к другому – трансаминаза), 3) гидролазы (реакции гидролиза, при которых из субстрата образуются два продукта – амилаза, липаза), 4) лиазы (негидролитическое присоединение к субстрату или отщепление от него группы атомов, при этом могут разрываться связи «С-С», «С-N», «С-О», «С-S» – декарбоксилаза), 5) изомеразы (внутримолекулярная перестройка – изомераза), 6) лигазы (соединение двух молекул в результате образования связей «С-С», «С-N», «С-О», «С-S» – синтетаза
|
|
|
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 352; Нарушение авторских прав?; Мы поможем в написании вашей работы!
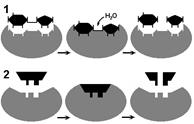 Соответствие фермента и субстрата:
1 — гипотеза «ключ – замок»; 2 — гипотеза «рука - перчатка».
Соответствие фермента и субстрата:
1 — гипотеза «ключ – замок»; 2 — гипотеза «рука - перчатка».
 Рис.. Зависимость скорости реакции от концентрации фермента, субстрата, рН, температуры
Рис.. Зависимость скорости реакции от концентрации фермента, субстрата, рН, температуры
 Рис.. Алостерическое активирование и ингибирование ферментов
Рис.. Алостерическое активирование и ингибирование ферментов