
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Випробування на чистоту
|
|
|
|
План
1. Предмет і завдання фармацевтичної хімії.
2. Основні показники якості субстанцій.
3. Властивості субстанцій.
4. Ідентифікація.
6. Випробування на чистоту.
7. Кількісне визначення.
Предмет і завдання фармацевтичної хімії
Фармацевтична хімія - наука, що вивчає способи отримання, будову, фізичні, фізико-хімічні та хімічні властивості лікарських засобів; взаємозв'язок між хімічною структурою речовин і дією на організм; методи контролю якості ліків та зміни, що відбуваються при їх зберіганні, а також застосування лікарських засобів в медицині.
Основними напрямками фармацевтичної хімії є: цілеспрямований пошук нових лікарських речовин, розробка та удосконалення методів оцінки якості лікарських засобів з метою забезпечення їх ефективності та безпеки.
Фармацевтична хімія - прикладна наука, що базується на теорії і законах таких хімічних наук, як неорганічна, органічна, аналітична, фізична і колоїдна хімія.
Завдання курсу фармацевтичної хімії - дати теоретичні основи спеціальних знань і практичну підготовку по стандартизації і контролю якості лікарських засобів.
Фармацевтичний аналіз - один з основних розділів фармацевтичної хімії, об'єктами якого є індивідуальні лікарські речовини (субстанції) різної хімічної природи та лікарські препарати (аптечного виготовлення і заводського виробництва).
Субстанція - це стандартизована біологічно активна речовина (зазвичай отримується шляхом синтезу) або стандартизована суміш біологічно активних речовин (зазвичай отримується з об'єктів рослинного або тваринного походження), використовувані для приготування готових лікарських засобів.
Якість субстанцій регламентується вимогами відповідних монографій ДФУ або відповідної аналітичної нормативної документації (АНД), затвердженої уповноваженим органом.
|
|
|
Державна фармакопея України (ДФУ) - це правовий акт, що містить загальні вимоги до лікарських засобів, фармакопейні статті (монографії), а також методики контролю лікарських засобів.
Основні показники якості субстанцій
Вступна частина. Вказують межі вмісту основної речовини, міжнародне найменування, хімічна назва (IUPAC), структурні и брутто-формули (для неорганічних субстанцій - молекулярну формулу), молекулярну масу.
Властивості.
Опис. Вказують характеристики фізичного стану и колір субстанції.
Запах. Визначення запаху проводитися (якщо це потрібно фармакопеєю) наступний чином: 0,5-2,0 г субстанції розподіляють тонким шаром на годинниковому склі діаметром 6- 8см; через 15 хвилин визначають запах або роблять висновок про його відсутність.
Розчинність. Розчинність субстанції є додаткова характеристикою її автентічності та чистоти. Розчинність в фармакопейних аналізах не є фізичною константою, це величина відносна і характеризує здатність субстанцій розчиняться в тихий чи других розчинниках.
Ідентифікація.
Ідентифікація (справжність). У даним розділі наводитися комплекс випробувань, призначене для підтвердження з прийнятних ступенів достовірності того, що лікарська речовина відповідає інформації, наведеної на етикетці. Для ідентифікації субстанції (у залежності від їх хімічної природи) застосовують поєднання фізико -хімічних методів: ІЧ - спектроскопії, УФ- спектрофотометрії, різних видів хроматографії з характерними хімічними реакціями.
Реакції ідентифікації катіонів та аніонів об'єднані в загальній статті Фармакопеї «Реакції ідентифікації на іоні и функціональні групи».
Реакції ідентіфікації на іоні (ДФУ)
Алюміній. До водного розчину субстанції додають кислоту хлористоводневу і тіоацетамідний реактив, при цьому не повинен утворюватися осад (випробування проводитися для підтвердження відсутності домішок важких металів).
|
|
|
При подальшому додаванні розчину натрію гідроксиду утворюється гелеоподібній білий осад, що розчиняється в надлишку реактиву.
Аl3+ + 3NaОН  Аl (ОН)3 + 3Na+
Аl (ОН)3 + 3Na+
Аl (ОН)3 + 3NaОН  Na3[ Аl (ОН)6]
Na3[ Аl (ОН)6]
Білий гелеподібній осад знову випадає при додаванні розчину амонію хлориду:
Nа3[ Аl(ОН)6] + NН4Сl  Аl (ОН)3 +3 NaСl +3NH4OH
Аl (ОН)3 +3 NaСl +3NH4OH
Cолі амонію. До розчину субстанції додають магнію оксид (для віділення аміаку з його солі). Через рідину пропускають струм повітря і вихідний газ направляються в суміш 0.1м розчину кислоти хлористоводневої і розчину метилового червоного. Про наявність іонів амонію видно по зміні забарвлення індикатора метилового червоного з червоного у жовтий. Потім у цьому розчині проводять реакцію з натрієм кобальтонітритом – утворюється жовтий осад:
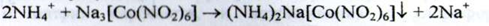
Солі амонію і солі летучих основ. При взаємодії солей амонію і летучих основ з розчином натрію гідроксиду при нагріванні виділяються пари аміака або летучих основ, які виявляються по запаху і лужній реакції:
t °

Броміди. а) При взаємодії бромід-іонів з розчином срібла нітрату при наявності кислоти азотної розведеної утворюється світло-жовтий сирнистий осад, повільно розчинний у розчині аміаку:
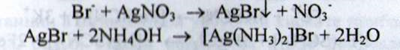
Б)При взаємодії бромід іонів з свинцем(IV) оксиду при наявності кислоти оцтової виділяється бром, який ідентифікують через виділення бром замінного фуксину, пофарбованого у фіолетовий колір (фуксин має червоний колір)
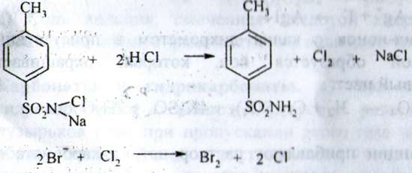
С) З розчином хлораміну при наявності кислоти хлористоводневої розведеної і хлороформа, броміди окислються з утворенням брома, який забарвлює хлороформ у жовто -бурий колір:
ВІСМУТ. А) субстанцію розчиняють в кислоті хлористоводневій розведеній. Кип'ятять 1 хвилину, охолоджують і при потребі фільтрують. До отриманого розчину додають воду, утворюється білий або світло - жовтий осад, який при додаванні розчину натрію сульфіду переходить у коричневий:

б) солі вісмуту з розчином тіосечовини при наявності кислоти азотної утворюють жовто-оранжеве забарвлення або осад, який не знебарвлюються протягом 30 хвилин після додавання натрію фторид:
|
|
|
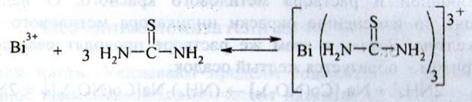
Залізо. а) При взаємодії іонів заліза (II) з розчином калію ферумуціаніда утворюється синій осад, що не розчиняється при додаванні кислоти хлористоводневої розведеної:
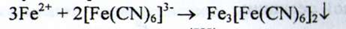
b) При взаємодії солей заліза (III) з розчином калію тіоціаната з'являється червоне забарвлення. Розчин ділять на дві частини. До однієї частини додають ізоаміловий спирт або ефір - органічний шар забарвлюється в рожевий колір. До іншої частини додають ртуті (II) хлорид, червоне забарвлення зникає:
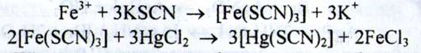
c) Солі заліза (III) з розчином калія ферроціаніда утворюють синій осад, що не розчиняється при додаванні кислоти хлористоводневої розведеної:
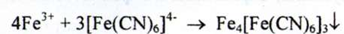
Йодиди. а) При взаємодії йодид - іонів з розчином срібла нітрату в присутності кислоти азотної розведеної утворюється світло -жовтий осад, що не розчиняється в розчині аміаку:
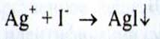
b) При взаємодії йодид – іонів з калієм дихроматом у присутності кислоти сірчаної розведеної утворюється йод, який забарвлює хлороформний шар в Фіолетовий колір:
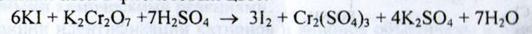
Калій. а) До розчину субстанції додають розчин натрію карбонату і нагрівають (осад не утворюється), до гарячого розчину додають натрію сульфід (осад не утворюється). Потім реакційну суміш охолоджують у крижаній воді і додають розчин кислоти винної - утворюється білий кристалічний осад:
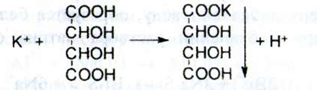
б) При взаємодії іонів калію з розчином натрію кобальтінітріта у присутності кислоти оцтової розведеної утворюється жовтий або помаранчево - жовтий осад:
2K+ + Na3[Co(NO2)6]  K 2Na[Co(NO2)6]
K 2Na[Co(NO2)6]  + 2Na+
+ 2Na+
в) Сіль калію, внесена в безбарвне полум'я, забарвлює його у фіолетовий колір (при розгляді через синє скло - в пурпурно - червоний).
Кальцій. а) При взаємодії іонів кальцію з розчином гліоксальгідроксіаніла в спирті в присутності розчину натрію гідроксиду розведеного і натрію карбонату, і струшування з хлороформом - хлороформний шар забарвлюється в червоний колір:
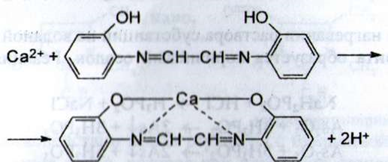
b) До розчину субстанції розведеної оцтової кислоти додають розчин калію ферроцианида, білий осад утворюється після додавання амонію хлориду:
|
|
|

c) При взаємодії катіонів кальцію з розчином амонію оксалату утворюється білий осад, нерозчинний в кислоті оцтовії розведеної і розчині аміаку, розчинний в розведених мінеральних кислотах:

d) Сіль кальцію, змочена кислотою хлористоводневою, внесена до безбарвного полум'я забарвлює його в оранжево -червоний колір.
Карбонати і гідрокарбонати. а) При взаємодії карбонатів і гідрокарбонатів з кислотою оцтової розведеної відбувається виділення бульбашок газу; при пропусканні цього газу через розчин барію гідроксиду утворюється білий осад, розчинний в кислоті хлористоводневій:
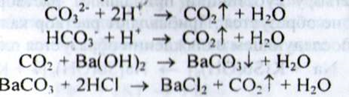
b) При взаємодії карбонатів з насиченим розчином магнію сульфату утворюється білий осад (гідрокарбонати утворюють осад тільки при кип'ятінні):
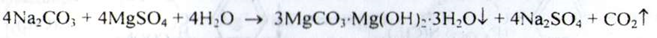
c) При додаванні фенолфталеїну до водного розчину карбонатів з'являється червоне забарвлення (розчини гідрокарбонатів залишаються безбарвними).
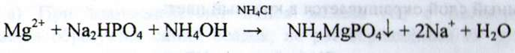
Магній. До водного розчину субстанції додають розчин аміаку розведеного - утворюється білий осад, який розчиняється при додаванні розчину амонію хлориду. При подальшому збільшенні до отриманої суміші розчину динатрія гідрофосфата утворюється білий кристалічний осад:
Миш'як. а) При нагріванні розчину субстанції на водяній бані з реактивом натрію гіпофосфіта утворюється коричневий осад. Реакція характерна для Аs3+ і Аs5+:
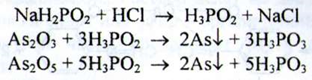
b) Попередньо до розчину субстанції додають кислоту хлористоводневу:
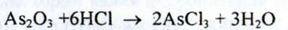
При подальшому додаванні розчину натрію сульфіду утворюється жовтий осад, нерозчинний в кислоті хлористоводневій концентрованій, розчинний у розчині аміаку:
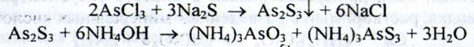
c) При взаємодії іонів миш'яку (Аз5+) з розчином магнію сульфату в присутності розчинів амонію хлориду і амонію гідроксиду утворюється білий кристалічний осад, розчинний в кислоті хлористоводневої розведеної (відмінність від арсенітов):
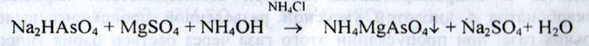
Натрій. а) До розчину субстанції додають розчин калію карбонату і нагрівають; осад не утворюється. Додають розчин калію піроантімоната - при нагріванні і наступному охолодженні утворюється щільний білий осад:
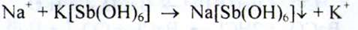
б) При взаємодії водного розчину субстанції з реактивом метоксіфенілоцетової кислоти утворюється об'ємний білий кристалічний осад, розчинний у розчині аміаку розведеного:

в) Сіль натрію, змочена кислотою хлористоводневою, забарвлює безбарвне полум'я в жовтий колір.
Нітрати. а) При взаємодії нітрат - іонів з сумішшю нітробензолу і кислоти сірчаної в присутності розчину натрію гідроксиду концентрованого і ацетону утворюється темно - фіолетове забарвлення.
b) Нітрати не знебарвлюють розчин калію перманганату, підкисленою кислотою сірчаної розведеної (відмінність від нітритів).
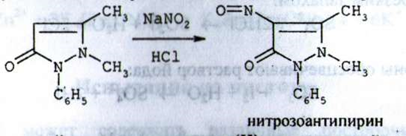
c) Нітрити з антипірином у присутності кислоти хлористоводневої розведеної утворюють зелене забарвлення (відмінність від нітратів):
Ртуть. а) При взаємодії іонів ртуті (II) з очищеною мідною фольгою утворюється темно - сіра пляма, яке при натиранні стає блискучим. При нагріванні фольги в пробірці пляма зникає:

b) При взаємодії іонів ртуті (II) з розчином натрію гідроксиду розведеним утворюється щільний жовтий осад:

c) При взаємодії іонів ртуті (II) з розчином калію йодиду утворюється червоний осад, розчинний в надлишку реактиву:
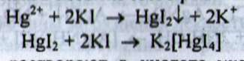
Свинець. а) Субстанцію розчиняють у кислоті оцтовій. При подальшому додаванні розчину калію хромату утворюється жовтий осад, розчинний у розчині натрію гідроксиду концентрованому:
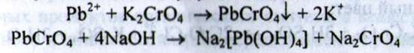
б) До розчину субстанції в кислоті оцтової додають розчин калію йодиду; утворюється жовтий осад, який розчиняється при нагріванні. При охолодженні розчину знову утворюється осад у вигляді блискучих жовтих пластинок:

Срібло. При взаємодії іонів срібла з кислотою хлористоводневою утворюється білий сирнистий осад, розчинний у розчині аміаку розведеному:

Сульфати. а) З розчином барію хлориду в присутності кислоти хлористоводневої розведеної утворюють білий осад:

б) До отриманої суспензії (див. реакцію а) додають розчину йоду; жовте забарвлення не зникає (відмінність від сульфітів і дитіонітів), але зникає при додаванні розчину олова хлориду (відмінність від йодидів):

Сульфіти. а) При взаємодії сульфіт - іонів з кислотою хлористоводневою розведеною поступово виділяється сірчистий газ з характерним різким запахом:
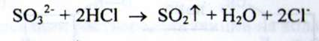
б) Сульфит - іони знебарвлюють розчин йоду:
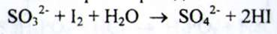
Фосфати. а) З розчином срібла нітрату фосфати утворюють жовтий осад, розчинний у розчині аміаку:
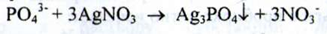
б) З молібденованадієвим реактивом фосфати утворюють жовте забарвлення:
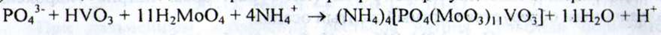
Хлориди. а) При взаємодії хлоридів з розчином срібла нітрату в присутності кислоти азотної розведеної утворюється білий сирнистий осад, розчинний у розчині аміаку:

б) Після взаємодії хлоридів з розчином калію дихромата і кислоти сірчаної, папір, просочений розчином дифенілкарбозида, забарвлюється у фіолетово - червоний колір:
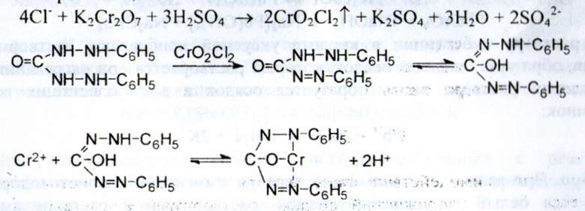
Цинк. а) При взаємодії іонів цинку з розчином натрія гідроксида концентрованого утворюється білий осад, розчинний в надлишку реактиву.
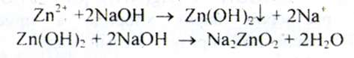
При додаванні до отриманого розчину амонію хлориду осад не утворюється, а при додаванні розчину натрію сульфіду - утворюється білий пластівчастий осад:
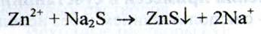
б) При взаємодії іонів цинку з розчином калію ферроцианида утворюється білий осад, нерозчинний в кислоті хлористоводневії розведеній:
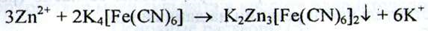
Субстанція може містити різні сторонні речовини, тобто домішками. Якісний і кількісний склад домішок для кожної лікарської речовини визначається технологією виробництва, встановлюється експериментальним шляхом і строго регламентується в розділі монографії або АНД «Випробування на чистоту». Даний розділ може включати наступні тести: прозорість і ступінь каламутності розчину, забарвлення розчину, реакція середовища, випробування на граничний вміст домішок, визначення сухого залишку, води, залишкових кількостей органічних розчинників.
Домішки в лікарських засобах носять не випадковий характер, а визначаються цілком закономірними джерелами.
Джерела і причини забруднення лікарських засобів:
1. У результаті отримання лікарських засобів. Основні джерела домішок - апаратура, вихідна сировина, розчинники та інші речовини, які використовують при отриманні лікарських засобів. Синтетичні лікарські субстанції зазвичай містять домішки вихідних і проміжних продуктів органічного синтезу, а речовини, одержувані з рослинної і тваринної сировини, нерідко мають домішки сторонніх екстрактивних речовин.
2. В результаті неправильного зберігання, коли не були враховані його властивості або порушені умови зберігання, внаслідок чого відбувається розкладання лікарського засобу, нерідко з утворенням продуктів, небезпечних для організму. Таким чином, умови зберігання можуть з'явитися причиною недоброякісності лікарських засобів.
Державна фармакопея регламентує визначення наступних типів домішок:
- Механічні включення;
- Супутні домішки (конкретно вказуються домішки, Неназиваємого домішки): напівпродукти та побічні продукти отримання, продукти розкладання, і в деяких випадках сторонні домішки. Для контролю супутніх домішок можуть застосовуватися різні хроматографічні і спектроскопічні методи або їх комбінації.
- Залишкові кількості органічних розчинників;
- Легкообвугливі речовини;
- Неорганічні катіони і аніони.
Способи визначення домішок у субстанції:
1. Хімічні: - з використанням і без використання еталонних розчинів.
Еталонні розчини - це розчини з точно відомою концентрацією іона. Еталонні розчини готують згідно з вимогами ДФУ, виходячи з чутливості реакції на даний іон.
При виборі реакції для випробування на чистоту загальними вимогами є наступні:
а) чутливість реакції в умовах досвіду;
б) специфічність;
в) відтворюваність.
Визначення домішок проводять колориметричним або нефелометричним способам, порівнюючи результати реакцій в розчині еталона і в розчині субстанції після додавання до них відповідних реактивів.
2. Фізико -хімічні (методи спектрофотометрії, хроматографії та ін.)
Зовнішній вигляд розчину субстанції (прозорість, забарвлення) - це візуальні випробування, призначені для оцінки чистоти субстанції (так як часто невідомо, які конкретно домішки і в якій концентрації обумовлюють опалесценцію або забарвлення розчину речовини) і базуються на порівнянні опалесценції(або забарвлення) досліджуваного розчину і еталонів.
Визначення прозорості і ступеня каламутності рідин (ДФУ)
Прозорість і ступінь каламутності рідин визначають шляхом порівняння випробуваної рідини з розчинником або еталоном.
Випробовану рідину вважають прозорою, якщо вона витримує порівняння з водою або розчинником, або її каламутність не перевищує каламутність еталону I.
40 -мм шар випробуваної рідини порівнюють з 40-мм шаром свіжоприготованого еталону в пробірках з внутрішнім діаметром від 15 до 25 мм, переглядаючи зразки уздовж вертикальної осі пробірок на чорному тлі.
Еталонами для визначення ступеня каламутності служать суспензії з гідразину сульфату і гексаметилентетраміну. Еталонів каламутності згідно ДФУ - чотири.
Визначення ступеня забарвлення рідини (ДФУ)
Розчин вважають безбарвним, якщо він витримує порівняння з водою або розчинником або пофарбований не більше інтенсивно, ніж еталон В9.
Забарвлення рідини визначають візуально шляхом порівняння з відповідним еталоном. Досліджувані рідини беруть у рівних кількостях з еталонними розчинами. Порівняння проводять в пробірках однакового скла і діаметра. Забарвлення випробуваного образка повинна бути ідентична еталону або наближена до відповідної забарвленнія, не перевищуючи її за інтенсивністю, але дещо відмінна по тону.
Еталонні розчини готують з основних, які, у свою чергу отримують змішуванням вихідних розчинів.
Вихідні розчини (3):
ü Жовтий розчин (розчин заліза (III) хлориду в кислоті хлористоводневії).
ü Червоний розчин (розчин кобальту хлориду в кислоті хлористоводневії).
ü Блакитний розчин (розчин міді сульфату в кислоті хлористоводневії).
Основні розчини (5):
отримують змішуванням вихідних розчинів:
Еталони готують з основних розчинів шляхом розбавлення їх розчином
кислоти хлористоводневої 10 г / л.
Є еталони:
Ø коричневих відтінків - шкала В;
Ø коричнево -жовтих відтінків - шкала ВY;
Ø жовтих відтінків - шкала Y;
Ø зеленувато -жовтих відтінків - шкала GY;
Ø червоних відтінків - шкала R.
Визначення ступеня забарвлення рідин проводять одним з двох методів:
Метод 1. 2,0 мл випробуваної рідини порівнюють з 2,0 мл еталона або води або розчинника, переглядаючи зразки в пробірках із зовнішнім діаметром 12 мм перпендикулярно осі пробірок на білому фоні.
Метод II. 40 -мм шар випробуваної рідини порівнюють з 40- мм шаром еталона або води або розчинника в пробірках з внутрішнім діаметром від 15 до 25 мм, переглядаючи зразки уздовж вертикальної осі пробірок на білому фоні.
Порівняння ступеня забарвлення рідини з еталонами (В, ВY, Y, GY, R)1-3 проводять за методом I; а з еталонами (В, ВY, Y, GY, R)4-9 - за методом 2.
Визначення реакції середовища (рН)
Важливу інформацію про ступінь чистоти препарату, його справжності дає значення рН його розчину. За цим значенням можна судити про наявність домішок кислих або лужних продуктів. Реакція (рН) середовища є характеристикою хімічних властивостей речовини. Ступінь кислотності або основності розчинів необхідно враховувати при виконанні випробувань доброякісності лікарських препаратів та кількісного визначення. Від значень рН розчинів залежать терміни зберігання лікарських речовин, а також особливості їх застосування. Важливе значення реакція середовища має для ін'єкційних розчинів.
рН яких має наближатися до рН сироватки крові (щоб вони не чинили дратівної дії).
При визначенні реакції середовища розчину ДФУ рекомендує використовувати два методи: інструментальний і індикаторний (колориметричний або визначення кислотності або лужності).
Потенціометричний метод (фізико - хімічний (електрохімічний) метод) визначення рН заснований на вимірюванні електрорушійної сили елемента, складеного з стандартного електрода (з відомим значенням потенціалу) і індикаторного електрода, потенціал якого залежить від рН випробуваного розчину. Для встановлення рН середовища використовують потенціометри або рН -метри різних марок. Потенціометричний спосіб визначення рН відрізняється від колориметричного більш високою точністю і зазвичай використовується для аналізу ін'єкційних розчинів.
Індикаторний метод визначення рН заснований на властивості індикаторів змінювати своє забарвлення за певних інтервалах значень рН середовища. Інтервали переходу забарвлення різних індикаторів наведені в таблиці ДФУ: «Залежність між реакцією середовища, приблизними значенням рН і кольором індикаторів».
Випробування на граничний вміст домішок
У розділі ДФУ «Випробування на граничний вміст домішок», наводяться методи контролю неспецифічних домішок, в основному неорганічних катіонів та аніонів.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 4625; Нарушение авторских прав?; Мы поможем в написании вашей работы!