
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние концентрации на химическое равновесие
В соответствии с принципом Ле Шателье введение в равновесную систему дополнительных количеств какого-либо реагента (имеется в виду исходное вещество или продукты реакции) вызывает сдвиг равновесия в том направлении, при котором концентрация этого вещества уменьшается.
Поэтому избыток исходного вещества вызывает смещение равновесия вправо, увеличивая степень превращения других реагентов. И наоборот, добавление продукта реакции вызывает смещение равновесия влево, т.е. уменьшение степени полноты ее протекания.
Если направление смещения равновесия в химическом процессе определяется избытком какого-либо из реагентов (исходного вещества или продуктов реакции), то степень смещения равновесия при данном количестве реагента определяется величиной стехиометрических коэффициентов.
Например:
Рассмотрим реакцию, протекающую в водном растворе (качественная реакция на ионы 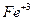 , которая используется при определении
, которая используется при определении  в нефтях и нефтепродуктах):
в нефтях и нефтепродуктах):

(роданид калия)
Константа равновесия этой реакции будет равна:
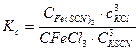
Вид этого выражения показывает не только направление, но и степень смещения равновесия. Изменение концентрации  или
или  вызовет более значительный сдвиг положения равновесия, чем изменение концентрации
вызовет более значительный сдвиг положения равновесия, чем изменение концентрации  или
или  , т.к. стехиометрические коэффициенты в уравнении реакции для
, т.к. стехиометрические коэффициенты в уравнении реакции для  и
и  втрое больше, чем для
втрое больше, чем для  и
и  .
.
Во многих случаях смещение равновесия вправо можно осуществить и удалением продуктов процесса из реакционной зоны, связывая их в малодиссоциирующие, труднорастворимые или нелетучие вещества.
|
|
Дата добавления: 2015-06-25; Просмотров: 449; Нарушение авторских прав?; Мы поможем в написании вашей работы!