
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорости прямой и обратной реакций. Равновесие. Константа равновесия. Термодинамический подход к рассмотрению равновесия
|
|
|
|
Тема 6. Обратимые химические реакции (объекты и методы управления).
Теоретически все химические реакции в большей или меньшей степени обратимы, то есть могут в одних и тех же условиях протекать в противоположных направлениях. Обратимость реакций была доказана на следующем опыте: сначала смесь газов H2 и O2 пропускали через раскалённую железную трубку; при этом образовывалось некоторое количество водяных паров по реакции 2H2+O2→t 2H2O (пар). При пропускании же водяных паров через ту же трубку наблюдалось частичное разложение воды на кислород и водород: 2H2O (пар) →t 2H2+O2. То есть реакция между водородом и кислородом обратима: 2H2+O2↔t 2H2O (пар).
Обратимые реакции широко распространены и используются в химической технологии.
Обратимые реакции никогда не доходят до конца, то есть до полного исчезновения исходных реагентов и превращения их в продукты реакции. Пределом протекания обратимых реакций при заданных условиях является достижение состояние химического равновесия.
Истинное химическое равновесие характеризуется следующими признаками: 1) в момент равновесия скорости прямой и обратной реакций одинаковы (равны), то есть: Uпрям=Uобр (1), или k1 cA cB=k2cCcD (2) 2) химическое равновесие подвижно 3) к одному и тому же состоянию химического равновесия можно подойти с двух сторон: A+B K1↔K2 C+D (3) 4) в момент достижения равновесия запас свободной энергии системы является минимальным, а энтропия – максимальной.
Учитывая (1), (2) и (3) для равновесного состояния отношение двух постоянных k1 и k2 будет: k1/k2=cCcD/cAcB=k – величина, называемая константой химического равновесия. То есть для химического равновесия отношение произведения равновесных (мольных) концентраций продуктов к произведению равновесных (мольных) концентраций исходных веществ есть величина постоянная при постоянной температуре. Она показывает во сколько раз k1>k2 и зависит от природы реагирующих веществ (так как в формуле отношение концентраций). Для веществ в газообразном состоянии удобно использовать парциальные давления: kp=pCpD/pApB.
|
|
|
Под термином химическое сродство понимают способность веществ вступать в химическое взаимодействие друг с другом. Сродство веществ друг с другом могут характеризовать изменение термодинамических потенциалов ∆F и ∆G.
Для термодинамически обратимой реакции общего вида n1A+n2B↔n3C+n4D изменение термодинамических потенциалов и химическое сродство при T=const подсчитывают, используя соотношения, выведенные Вант-Гоффом и названные уравнениями изотермы химической реакции:
∆FT=RT(ln  -lnkC) (4); ∆GT=RT(ln
-lnkC) (4); ∆GT=RT(ln 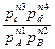 -lnkP) (5), где k – константы равновесия при температуре Т, с – концентрации, реагирующих веществ, n – их число молей, p – парциальные давления взаимодействующих газов. По этим уравнениям можно определить, в каком направлении, и до какого состояния равновесия может протекать реакция в нужном направлении. Если ∆FT и ∆GT имеют знак “-”, то реакция может протекать только в прямом направлении, и наоборот, если ∆FT=0 и ∆GT=0, то система достигла равновесного состояния. При концентрациях и давлениях равных единице, получим ∆F0T=-RTlnkC; или
-lnkP) (5), где k – константы равновесия при температуре Т, с – концентрации, реагирующих веществ, n – их число молей, p – парциальные давления взаимодействующих газов. По этим уравнениям можно определить, в каком направлении, и до какого состояния равновесия может протекать реакция в нужном направлении. Если ∆FT и ∆GT имеют знак “-”, то реакция может протекать только в прямом направлении, и наоборот, если ∆FT=0 и ∆GT=0, то система достигла равновесного состояния. При концентрациях и давлениях равных единице, получим ∆F0T=-RTlnkC; или
-∆F0T=2,303RTlgkC. Убыль величины изобарного потенциала рассчитывают по формуле: ∆G0T=2,303∆nRT lg1,0133*105-2,303RTlgkP (6), где ∆n – изменение числа молей газообразных веществ в реакции, равное алгебраической сумме: ∆n =n3+n4-n1-n2. По уравнениям (5 и 6), определив предварительно ∆GT (по таблице) можно определить константы равновесия kP и kC.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 568; Нарушение авторских прав?; Мы поможем в написании вашей работы!