
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 7
|
|
|
|
Скорость гомогенной реакции. Кинетическое уравнение реакции. Основные принципы химической кинетики (зависимость скорости от концентрации, суммарная скорость сложной реакции и скорость лимитирующей стадии). Константа скорости. Законы скоростей реакций 1-го и 2-го порядков. Полупериод реакции.
Тема 3. Кинетические закономерности физико-химических процессов.
Для химической технологии важен конкретный вид уравнения, позволяющего рассчитывать скорость химической реакции при различных условиях её проведения.
Скорость химической реакции wRJ принято выражать количеством (моль) nJ одного из реагентов или продуктов, прореагировавшем (или образовавшемся) в единицу времени τ в единице реакционного пространства. Под реакционным пространством в гомогенных реакций понимают объём реактора, гетерогенных – поверхность раздела фаз, гетерогенно-каталитических – поверхность раздела фаз или количество катализатора). Для гомогенной химической реакции: W=+- 1dnJ/Vdr, где V - реакционный объём. Если J – исходный реагент, то знак отрицателен, если-продукт, то положителен. Если реакция идёт при постоянном объёме, то скорость можно выразить через молярную концентрацию: CJ=nJ/V. Если в реакции участвует несколько реагентов и получается несколько продуктов, то вводят дополнительно стехиометрический коэффициент j и скорость определяют:
w RJ =± 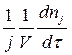 = ±
= ± 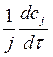 , тогда скорость численно будет одинакова по каждому компоненту реакции [w]=моль/м3*с или [w]=моль/л*с.
, тогда скорость численно будет одинакова по каждому компоненту реакции [w]=моль/м3*с или [w]=моль/л*с.
Скорость зависит от большого числа переменных величин: не только от температуры, давления и состава реакционной системы, но и от иных причин, например, посторонних примесей и др.
Факторы, оказывающие влияние на скорость реакций, делятся на две группы: чисто кинетические (микрокинетические), определяющие скорость взаимодействия на молекулярном уровне, и макрокинетические, определяющие влияние на скорость взаимодействия условий транспорта реагентов к зоне реакций – наличие перемешивания, геометрических размеров реактора.
|
|
|
Рассмотрим влияние микрокинетических факторов.
Законы химической кинетики основаны на двух простых принципах (постулатах):
1)скорость химической реакции пропорциональна концентрации реагентов,
2)суммарная скорость нескольких последовательных превращений, разлагающихся по скорости, определяется скоростью наиболее медленной стадии.
Функциональная зависимость скорости химической реакции от концентраций компонентов реакционной смеси w R=f(cA, cB, …cJ) называется кинетическим уравнением реакции. Такое уравнение для элементарной реакции: aA+bB→rR+sS будет: w R=kcAacBb (1), в соответствии с первым постулатом, где k- константа скорости реакции, показатели а и b называются порядками реакций по реагентам А и В. (2) a+b=n – общий порядок. “Молекулярность реакции” равна минимальному числу молекул, одновременно принимающих участие в элементарном акте реакции. Для элементарных реакций порядок равен молекулярности и может иметь значения: 1,2,3. Порядок элементарных реакций не может превышать значения 3, так как вероятность одновременного столкновения более чем трёх молекул чрезвычайно мала. Большинство элементарных реакций – это реакции второго порядка. Используя уравнение (2), можно определить скорость реакций первого и второго порядков, задавая величины a и b. n=1, если a=0,5 и b=0,5; n=2 при a=1, b =1. Простые реакции могут иметь лишь целочисленные значения порядков.
Большинство химических реакций не являются простыми, они протекают через ряд промежуточных стадий. Стехиометрическое уравнение сложной реакции отражает лишь начальное и конечное состояние данной реакционной системы и не описывает механизм реакции. Т. е. сложную реакцию иногда удобно рассматривать как формальную простую и считать, что она протекает в одну, а не в несколько стадий.
|
|
|
Для формально простой реакции: aA+bB→rR+sS, тогда скорость wRA=kcAαcBβ,здесь α и β находят экспериментально и они в общем случае α≠a и β≠b. Полный порядок n=α+β и частные порядки могут быть нецелочленными. Пусть α+β+…=∑nC; если ∑nC=1 – то реакция первого порядка, если ∑nC=2 – то реакция второго порядка, если ∑nC=3 – третьего порядка. Реакции более высоких порядков не наблюдаются.
Наряду с неэлементарными реакциями существует много сложных реакций, которые явно распадаются на стадии (продукты различных стадий образуются в значительных количествах и остаются до конечной стадии). Сложные реакции могут быть параллельными и последовательными. Примером последовательных реакций могут служить реакции расщепления углеводородов с длинной углеводородной цепочкой на всё более мелкие молекулы. Скорость реакции по одному из веществ – её участников – равна алгебраической сумме скоростей тех элементарных стадий, в которых это вещество принимает участие. Скорости стадий компонента J, в которых он расходуется, записываются со знаком плюс, а скорости стадий, в которых компонент J образуется (продукт) записываются со знаком минус, и результирующая скорость будет определяться разностью скоростей на отдельных стадиях, одна из которых будет определять направление реакций и, таким образом, будет являться лимитирующей стадией процесса.
Скорость последовательных стадий в нестационарном режиме различаются между собой, а скорость процесса в целом равна скорости самой медленной стадии, то есть лимитирующей стадии. В стационарном режиме скорость отдельных последовательных стадий “подстраивается” под скорость самой затруднённой стадии; они равны между собой и равны общей скорости процесса: w1= w2=…= wi=…=wz.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 430; Нарушение авторских прав?; Мы поможем в написании вашей работы!