
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Активность и коэффициент активности. Ионная сила раствора
|
|
|
|
Неподчинение растворов сильных электролитов закону действия масс, а также законам Рауля и Вант-Гоффа объясняется тем, что эти законы применяются к идеальным газовым и жидким системам. При выводе и формулировке этих законов не учитывались силовые поля частиц. В 1907 г. Льюис предложил внести в науку понятие «активность».
Активность (α) учитывает взаимное притяжение ионов, взаимодействие растворенного вещества с растворителем, присутствие других электролитов и явления, изменяющие подвижность ионов в растворе. Активностью называется эффективная (кажущаяся) концентрация вещества (иона), соответственно которой ионы проявляют себя в химических процессах в качестве реальной действующей массы. Активность для бесконечно разбавленных растворов равна молярной концентрации вещества: α = с и выражается в грамм ионах на литр.
Для реальных растворов вследствие сильного проявления межионных сил активность меньше молярной концентрации иона. Поэтому активность можно рассматривать как величину, характеризующую степень связанности частиц электролита. С понятием «активность» связано и другое понятие - «коэффициент активности» (f), который характеризует степень отклонения свойств реальных растворов от свойств идеальных растворов; он является величиной, отражающей все происходящие в растворе явления, вызывающие понижение подвижности ионов и снижающие их химическую активность. Численно коэффициент активности равняется отношению активности к общей молярной концентрации иона:
| f = | a |
| c |
а активность равна молярной концентрации, умноженной на коэффициент активности: α = cf.
Для сильных электролитов молярную концентрацию ионов (с) вычисляют, исходя из допущения полной диссоциации их в растворе. Физико-химики различают активную и аналитическую концентрацию ионов в растворе. Активной концентрацией называется концентрация свободных гидратированных ионов в растворе, а аналитической концентрацией — общая молярная концентрация ионов, определяемая, например, путем титрования.
Коэффициент активности ионов зависит не только от концентрации ионов данного электролита, но и от концентрации всех посторонних ионов, присутствующих в растворе. Величина коэффициента активности понижается с возрастанием ионной силы раствора.
Ионной силой раствора (m,) называется величина электрического поля в растворе, являющаяся мерой электростатического взаимодействия между всеми ионами в растворе. Она вычисляется по формуле, предложенной Г. Н. Льюисом и М. Ренделом в 1921 г.:
| m = | (c 1 Z21 + c 2 Z22 + ...... + c n Z2n) | |
где c 1, c 2 и c n — молярные концентрации отдельных ионов, присутствующие в растворе, a Z21, Z22 и Z2n — их заряды, взятые в квадрате. Недиссоциированные молекулы, как не имеющие зарядов, в формулу подсчета ионной силы раствора не включаются.
Таким обраэом, ионная сила раствора равна полусумме произведений концентраций ионов на квадраты их зарядов, что можно выразить уравнением: µ = 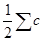 i · Z i 2
i · Z i 2
Рассмотрим несколько примеров.
Пример 1. Вычислить ионную силу 0,01 М раствора хлорида калия КС1.
Решение.
[K+] = [Cl-] = 0,01; Z K = ZCl- = 1
Следовательно,
| m = | (0,01 · 12 + 0,01 · 12) = 0,01 | |
т. е. ионная сила разбавленного раствора бинарного электролита типа KtAn равна молярной концентрации электролита: m = с.
Пример 2. Вычислить ионную силу 0,005 М раствора нитрата бария Ва(NO3)2.
Решение.
Схема диссоциации: Ва(NO3)2 ↔ Ва2+ + 2NO3-
[Ва2+] = 0,005, [NО3-] = 2 · 0,005 = 0,01 (г-ион/л)
Следовательно,
| m = | (0,005 · 22 + 0,01· 12) = 0,015 | |
Ионная сила разбавленного раствора электролита типа KtAn2 и Kt2An равна: m = 3 с.
Пример 3. Вычислить ионную силу 0,002 М раствора сульфата цинка ZnSO4.
Решение.
[Zn2+] = [SO42-] = 0,002, ZZn2+ = ZSO42- = 2
| m = | (0,002 · 22 + 0,002 · 22) = 0,008 | |
Отсюда, ионная сила раствора электролита типа Kt2+An2- равна:m = 4 с.
В общем виде для электролита типа Кtn+ a Аnm-b ионную силу раствора можно вычислять по формуле: m = 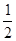 (а · [Kt+] · п2 + b · [An-]· т2),
(а · [Kt+] · п2 + b · [An-]· т2),
где а, b — индексы при ионах, а п+ и т- — заряды ионов, [Kt+] и [An-]- концентрации ионов.
Если в растворе присутствует два или несколько электролитов, то вычисляется общая ионная сила раствора.
Примечание. В справочниках по химии даются дифференцированные коэффициенты активности отдельных ионов или же для групп ионов. (См.: Лурье Ю. Ю. Справочник по аналитической химии. М., 1971.)
С увеличением концентрации раствора при полной диссоциации молекул электролита количество ионов в растворе значительно»возрастает, что приводит к увеличению ионной силы раствора и значительному уменьшению коэффициентов активности ионов. Г. Н. Льюис и М. Рендель нашли закон ионной силы, согласно которому коэффициенты активности ионов одной и той же зарядности одинаковые во всех разбавленных растворах, имеющих одинаковую ионную силу. Однако этот закон применим лишь к очень разбавленным водным растворам, с ионной силой до 0,02 г-ион/л. При дальнейшем повышении концентрации, а следовательно, и ионной силы раствора начинаются отступления от закона ионной силы, вызываемые природой электролита (табл. 2.2).
Таблица 2.2 Приближенные значения коэффициентов активности при разной ионной силе
| Значения f для ионов разной зарядности | Ионная сила раствора m: | ||||||||
| 0,0005 | 0,001 | 0,0025 | 0,005 | 0,01 | 0,05 | 0,1 | 0,2 | ||
| Для Н+ Для ОН- | 0,975 0,903 0,802 0,678 0,975 0,975 | 0,964 0,870 0,73 0,58 0,97 0,964 | 0,945 0,805 0,64 0,45 0,95 0,946 | 0,925 0,742 0,51 0,35 0,93 0,926 | 0,900 0,67 0,44 0,25 0,91 0,90 | 0,81 0,45 0,24 0,10 0,86 0,81 | 0,76 0,37 0,18 0,06 0,83 0,76 | 0,70 0,24 0,08 0,03 0,76 0,70 |
В настоящее время для аналитических вычислении пользуются таблицей приближенных значений коэффициентов активности.
Зависимость коэффициентов активности ионов от ионной силы раствора для очень разбавленных растворов электролитов вычисляется по приближенной формуле Дебая — Хюккеля:
lg f = - AZ2 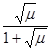 ,
,
где А — множитель, величина которого зависит от температуры (при 15°С, А = 0,5).
При значениях ионной силы раствора до 0,005 величина 1 + 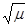 очень близка к единице. В этом случае формула Дебая — Хюккеля
очень близка к единице. В этом случае формула Дебая — Хюккеля
приобретает более простой вид:
lg f = - 0,5 · Z2 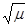 .
.
В качественном анализе, где приходится иметь дело со сложными смесями электролитов и где часто не требуется большой точности, при вычислении активностей ионов можно пользоваться таблицей 2.2.
Пример 4. Вычислить активность ионов в растворе, содержащем в 1 л 0,001 моль сульфата калия-алюминия.
Решение.
1. Вычислим ионную силу раствора:
| m = | ([K+]·12+[Al3+]·32)+2[SO2-4] ·22) = | (0,001 ·1+0,001·9+2 ·0,001 ·4)= | ||
=0,009
2. Находим приближенное значение коэффициентов активности данных ионов. Так, в рассматриваемом примере ионная сила равна 0,009. Наиболее близкой к ней ионной силой, указанной в таблице 2.2, является 0,01. Следовательно, без большой погрешности можно взять для ионов калия fK+ = 0,90; для ионов алюминия f Al3+ = 0,44, а для сульфат-ионов f SO2-4 = 0,67.
3. Вычислим активность ионов:
а K+ = cf = 0,001· 0,90 = 0,0009 = 9,0· 10-4 (г-ион/л)
a Al3+ = cf = 0,001·0,44 = 0,00044 = 4,4 · 10-4 (г-ион/л)
a SO2-4 = 2cf = 2 · 0,001· 0,67 = 0,00134 = 1,34 · 10-3 (г-ион/л)
В тех случаях, когда требуются более строгие вычисления, коэффициенты активности находятся или по формуле Дебая - Хюккеля, или же путем интерполяции по таблице 2.2.
Решение примера 4 с использованием метода интерполяции.
1. Находим коэффициент активности ионов калия fK+.
При ионной силе раствора, равной 0,005, fK+ равен 0,925, а при ионной силе раствора, равной 0,01, fK+, равен 0,900. Следовательно, разности ионной силы раствора m, равной 0,005, соответствует разность fK+, равная 0,025 (0,925—0,900), а разности ионной силы m, равной 0,004 (0,009 — 0,005), соответствует разность fK+, равная х.
Отсюда, х = 0,020. Следовательно, fK+ = 0,925 — 0,020 = 0,905
2. Находим коэффициент активности ионов алюминия f Al3+. При ионной силе, равной 0,005, f Al3+ равен 0,51, а при ионной силе, равной 0,01, f Al3+ равен 0,44. Следовательно, разности ионной силы m, равной 0,005, соответствует разность f Al3+, равная 0,07 (0,51 — 0,44), а разности ионной силы m, равной 0,004, соответствует разность f Al3+ равная х.
откуда х = 0,07·0,004/ 0,005 = 0,056
Значит, f Al3+ = 0,510 - 0,056 = 0,454
Так же находим коэффициент активности сульфат-ионов.
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 30491; Нарушение авторских прав?; Мы поможем в написании вашей работы!