
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы выражения концентрации
Молярная концентрация, сВ, моль/дм3, ммоль/см3 – это отношение числа молей растворенного вещества к объему его раствора.
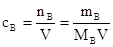 ,
,
где nB – количество растворенного вещества, моль;
V - объём раствора, дм3;
mB – масса растворенного вещества, г;
МB – молярная масса вещества, г / моль.
Этот термин распространяется на любой вид условных частиц (атомы, ионы, молекулы, части молекул и т. д.). В аналитической практике молярную концентрацию выражают в моль/дм3. Например с(НCl) = 0,1 моль/ дм3; с(Н2SO4) = 0,2 моль/дм3.
Массовая концентрация – это отношение массы растворенного вещества «m» к объему раствора «V », единицы измерения: кг/дм3; а также кратные и дольные единицы. Массовую концентрацию, выраженную в г/cм3 называют титром (ТВ). Эта единица дала название классическому методу анализа – титриметрия.
Объемная концентрация – отношение объема растворенного вещества к объему раствора.
Доля компонента от общего количества вещества. Доля означает отношение числа частей компонента к общему числу частей объекта. В зависимости от выбранной единицы различают массовую (ω), молярную (α), объемные доли (φ).

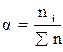
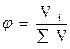
Долю выражают:
-в процентах (доля умноженная на 100);
-миллионных долях (ppm, доля умноженная на 106);
-миллиардных долях (ppb, доля умноженная на 109);
-триллионных долях (ppt, доля умноженная на 1012).
Моляльность – количество вещества в единице массы (1 кг) растворителя. Преимущество моляльности – в независимости от температуры.
Молярная концентрация эквивалента СЭ (устаревшее название “нормальность”) - это отношение количества вещества эквивалента в растворе к объему этого раствора. Единица измерения – моль/дм3.

где V – объём раствора, дм3; mВ – масса растворенного вещества, г; М( ) – молярная масса эквивалента, г/моль.
) – молярная масса эквивалента, г/моль.
Эквивалент. Между условными частицами в соединениях существуют определенные соотношения, называемые стехиометрическими. Например в молекуле Н2СО3 два протона связаны с одной частицей СО32- . Между реагирующими частицами также устанавливаются стехиометрические отношения, например в реакции
aА + bВ = сС + dD
a условных частиц вещества А реагируют с b условными частицами вещества В. Следовательно одна частица А эквивалентна b/a частицам вещества В. Отношение b/aназывают фактором эквивалентности вещества В и обозначают fэкв(В
Д ля расчета фактора эквивалентности и эквивалента необходима фиксированная основа, так как одного стехиометрического уравнения реакции для проведения расчета не всегда бывает достаточно. Такой основой в реакциях кислотно-основного взаимодействия является ион водорода, а в окислительно-восстановительных реакциях – электрон. Это и позволяет сделать определение фактора эквивалентности и эквивалента.
Фактор эквивалентности (fэкв) – число, обозначающее, какая доля реальной частицы веществ (х) эквивалентна одному иону водорода (z) в кислотно-основных реакциях или одному электрону (z) в окислительно-восстановительной реакции.
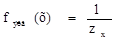
где zx – число ионов водорода (кислотно-основные реакции) или число электронов (окислительно-восстановительные реакции), х - химическая формула вещества
Эквивалентом называют реальную или условную частицу вещества х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной реакции окисления восстановления – одному электрону.
Молярной массой эквивалента вещества (Мэ, г/моль) называют массу одного моль эквивалента этого вещества, равную произведению фактора эквивалентности на молярную массу вещества В.
М(1/2Н2SO4) = ½ · 98 = 49 г/моль.
Под молярной массой эквивалента понимают некоторую реальную частицу, которая может присоединять, высвобождать или быть эквивалентной одному иону водорода или одному электрону. Она зависит от типа реакции, т.е. не является величиной постоянной.
На основе закона эквивалентов можно вывести следующие формулы для вычисления эквивалентных масс сложных веществ:

для оксида

кислоты
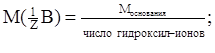
для основания
соли  .
.
Пример 1. Определить молярную массу эквивалента хлора, серы, азота и углерода в соединениях HCl, H2S, NH3, CH4.
Решение. В данных соединениях с 1 моль атомов водорода соединяется с 1 моль хлора, 1/2 моль серы, 1/3 моль азота, 1/4 моль углерода. Следовательно, молярные массы эквивалентов элементов равны:
М(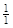 HCl) = 1·36,45 = 36,45 г/моль; М(
HCl) = 1·36,45 = 36,45 г/моль; М( H2S) =
H2S) = 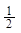 ·34 =17 г/моль
·34 =17 г/моль
М( NH3) =
NH3) =  ·17= 5,67 г/моль; М(
·17= 5,67 г/моль; М( CH4) =
CH4) = 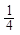 ·16 =4 г/моль
·16 =4 г/моль
В окислительно-восстановительных реакциях молярные массы эквивалентов восстановителя и окислителя должны быть отнесены к числу электронов, участвующих в переносе заряда.
Например, реакция
5Fe2+ + MnO4 - + 8H+ = 5Fe3+ + Mn2+ + 4H2O
состоит из полуреакций:
Fe2+- 1е- = Fe3+
MnO4 - + 8H+ + 5е- = Mn2+- + 4H2O
Молярная масса эквивалента:
1) железа – М(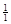 Fe) = 55,85 г/моль;
Fe) = 55,85 г/моль;
2) перманганата калия – М( КMnO4) =
КMnO4) =  ·158,04 = 31,61 г/моль.
·158,04 = 31,61 г/моль.
Таблица 4.1- Множители и приставки для образования десятичных кратных и дольных единиц.
| Приставка | Множитель | Приставка | Множитель | ||
| Гига | Г | 109 | деци | д | 10-1 |
| мега | М | 106 | санти | с | 10-2 |
| кило | к | 103 | милли | м | 10-3 |
| гекто | г | 102 | микро | мк | 10-6 |
| дека | да | нано | н | 10-9 | |

|
|
Дата добавления: 2015-07-02; Просмотров: 542; Нарушение авторских прав?; Мы поможем в написании вашей работы!