
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изомерия и номенклатура. 3 страница
|
|
|
|
45 Под методами учебно-воспитательной работы в школе следует понимать пути и способы, посредством которых учитель передает учащимся научные знания, познавательные и трудовые умения и навыки, организует самостоятельную работу учащихся, включает их в общественно-практическую деятельность, осуществляет их развитие и воспитание, а ученики овладевают знаниями, умениями и навыками развивают познавательные, мыслительные и творческие способности, приобретают морально-нравственные и другие положительные качества личности. Наиболее широкое распространение получило деление методов обучения по источникам познания (словесные, наглядные, практические); по решению основных дидактических задач (приобретение знаний, формирование умений и навыков, применение знаний, творческой деятельности, закрепление и проверка знаний, умений, навыков); по характеру познавательной деятельности при усвоении содержания образования (объяснительно-иллюстративный, репродуктивный, исследовательский, эвристический); по сочетанию методов преподавания и учения (информационно-сообщающий и исполнительный, объяснительный и репродуктивный, инструктивно-практический и продуктивно-практический, объяснительно-побуждающий и частично-поисковый, побуждающий и поисковый) и др.Некоторые методисты выделяют методы программированного, проблемного, исследовательского и алгоритмизированного обучения.
В процессе преподавания химии применяется монологическое и диалогическое устное изложение. К монологическим видам относятся кратковременное (до 20 мин.) и длительное изложение (до 45 мин.). Кратковременное изложение называют рассказом и объяснением, длительное - лекцией. К диалогическим (разговорным) видам изложения относятся эвристическая, обобщающая и контрольно-учетная беседы. Для всех видов бесед общим является то, что учитель ставит вопросы, а учащиеся на них дают ответы. В задачу эвристической беседы входит приобретение учащимися новых знаний при исследовательском подходе и максимальной активности учащихся; в задачу обобщающей беседы - систематизация и закрепление приобретенных знаний; в задачу контрольно-учетной беседы - контроль полноты, систематичности, правильности, осознанности, конкретности, действенности и прочности знаний, исправление обнаруженных недостатков, оценка и закрепление знаний.В VIII—IХ классах применяется главным образом комбинированное изложение, т. е. рассказ и объяснение учителя в сочетании с различными видами беседы.Являясь самостоятельным методом сообщения и закрепления знаний, устное изложение вместе с тем сопутствует, объединяет и направляет все другие методы, применяемые в обучении. Правильно применяемое изложение обеспечивает такое усвоение учебного материала, при котором с каждым термином в сознании учащихся возникают конкретные образы и понятия, а с каждой формулировкой - суждения, отражающие реальные свойства, отношения и связи веществ и химических явлений. Чтобы изложение было доходчивым, в его структуре должны быть следующие части: вступление, изложение, заключение. Наглядные методы обучения. В основе наглядных методов обучения лежит непосредственное восприятие учащимися изучаемых предметов, явлений и процессов природы, общественной жизни, языка, искусства или плоскостных и объемных наглядных пособий, изображающих эти предметы и явления. Различают: а) демонстрационный и б) лабораторный учебный эксперимент. Демонстрационный эксперимент заключается в том, что опыт показывается учителем или одним-двумя учащимися по заданию учителя, а весь класс наблюдает показываемый опыт, участвует в его анализе и разъяснении.Лабораторный эксперимент состоит в том, что учащиеся под руководством учителя самостоятельно выполняют опыт, руководствуясь устной или письменной инструкцией. В зависимости от организации лабораторного химического эксперимента, он разделяется на фронтальный и разбросной, индивидуальный и звеньевой, проводимый по письменной и по устной инструкции. Демонстрирование. Демонстрационные опыты проводятся с целью создания у учащихся определенных представлений о веществах, химических явлениях и процессах с последующим формированием химических понятий. Демонстрационный эксперимент проводится, когда: опыт сложный и не может быть осуществлен самими учащимися; учащиеся не владеют нужной техникой для проведения данного опыта; лабораторные опыты не дают должного результата; в распоряжение учащихся невозможно предоставить необходимое количество оборудования; опыты представляют некоторую опасность для учащихся.Иллюстративный метод целесообразен при объяснении сложных вопросов, требующих полного предварительного осмысления и понимания со стороны учащихся. Наблюдение. Наблюдения совершаются тем успешнее, чем лучше разъяснены их необходимость и цель, чем лучше учащиеся подготовлены к этим наблюдениям. Практические методы -учебный эксперимент, который является одновременно и способом добывания знаний и видом практики, подтверждающей их истинность. Практические занятия бывают двух видов: проводимые по инструкции и экспериментальные задачи.Инструкция является ориентировочной основой деятельности учащихся. В ней подробно в письменном виде должен быть изложен каждый этап выполнения опытов, даны предписания как избежать возможных ошибочных действий, указания по технике безопасности к данной работе.Экспериментальные задачи не содержат инструкции, а только условие. Учащиеся должны самостоятельно разработать план решения и осуществить его на практике, получив тем самым определенный материальный результат.
общие методы обучения, разработанные дидактикой и адаптированные к обучению химии.Перечислим общие методов обучения: объяснительно-иллюстративный; репродуктивный; проблемное изложение изучаемого материала; частично-поисковый или эвристический метод; исследовательский метод.Другая часть – частные (конкретные) методы. В зависимости от того, какой источник знания является основным, частные методы объединяют в три группы: словесные, наглядные и практические. Общие и частные методы переплетаются и взаимно дополняют друг друга. Практически каждый частный метод обучения может быть реализован на репродуктивном или частично-поисковом уровнях. В свою очередь, общие методы имеют конкретное проявление через определенные частные методы. Выбор методов обучения биологии определяется: объемом и содержанием учебного материала; личностью учителя; возрастом учащихся; подготовленностью и эрудицией учащихся; микроклиматом в классе; наличием ТСО и средств наглядности; количеством учащихся в классе и их однородностью; конкретной целью и задачами, поставленными перед уроком. Значение методов состоит в том, что, будучи выбранными соответственно содержанию учебного материала, возрасту учащихся и средств наглядности, они обеспечивают высокую усвояемость и качество знания, и оказывают воспитывающее влияние.
|
|
|
|
|
|
|
|
|
46 Дисперсные системы – это гетерогенные системы, состоящие из двух или большего числа фаз с сильно развитой поверхностью раздела между ними.Особые свойства дисперсных систем обусловлены именно малым размером частиц и наличием большой межфазной поверхности. В связи с этим определяющими являются свойства поверхности, а не частиц в целом. Характерными являются процессы, происходящие на поверхности, а не внутри фазы. Отсюда становится понятным, почему коллоидную химию называют физико-химией поверхностных явлений и дисперсных систем. Особенность дисперсных систем состоит в их дисперсности – одна из фаз обязательно должна быть раздробленной, ее называют дисперсной фазой. Сплошная среда, в которой распределены частицы дисперсной фазы, называется дисперсионной средой. Фаза считается дисперсной, если вещество раздроблено хотя бы в одном направлении. Если вещество раздроблено только по высоте, образуются пленки, ткани, пластины.Если вещество раздроблено и по высоте и по ширине, образуются волокна, нити, капилляры. Наконец, если вещество раздроблено по всем трем направлениям, дисперсная фаза состоит из дискретных (отдельных) частиц, форма которых может быть самой разнообразной.классификационногопризнака- Грубодисперсные (>10мкм): сахар-песок, грунты, туман, капли дождя, вулканический пепел, магма - Среднедисперсные (0,1-10мкм): эритроциты крови человека, кишечная палочка- Высокодисперсные 1-100нм): вирус гриппа, дым, муть в природных водах, искусственно полученные золи различных веществ, Наноразмерные (1-10нм): молекула гликогена, тонкие поры угля, золи металлов, Именно размер частиц (линейный размер, а не вес и не число частиц атомов в частице!) является важнейшим количественным показателем дисперсных систем, определяющим их качественные особенности. Под взаимодействием фаз дисперсных систем подразумевают процессы сольватации (гидратации в случае водных систем), образование сольватных (гидратных) оболочек из молекул дисперсионной среды вокруг частиц дисперсной фазы. Соответственно,по интенсивности взаимодействия между веществами дисперсной фазы и дисперсионной среды (только для систем с жидкой дисперсионной средой), по предложению Г.Фрейндлиха различают следующие дисперсные системы:- Лиофильные (гидрофильные, если ДС – вода):мицеллярные растворы ПАВ, критические эмульсии, водные растворы некоторых природных ВМС, например, белков (желатина, яичного белка), полисахаридов (крахмала).Для них характерно сильное взаимодействие частиц ДФ с молекулами ДС. В предельном случае наблюдается полное растворение.Лиофильные дисперсные системы образуются самопроизвольно вследствие процесса сольватации. Термодинамически агрегативно устойчивы.- Лиофобные (гидрофобные, если ДС – вода): эмульсии, суспензии, золи. Для них характерно слабое взаимодействие частиц ДФ с молекулами ДС. Самопроизвольно не образуются, для их образования необходимо затратить работу.Термодинамически агрегативно неустойчивы, их относительная устойчивость обусловлена кинетическими факторами.В соответствии с кинетическими свойствами дисперсной фазы различают свободнодисперсные и связнодисперсные системы.Выделяют также разбавленные и концентрированные системы. В связнодисперсных системах одна из фаз структурно закреплена и не может перемещаться свободно. В свободнодисперсных системах частицы обособлены и участвуют в тепловом движении и диффузии. В разбавленных связнодисперсных системах частицы образуют сплошную пространственную сетку (дисперсную структуру) – возникают гели. Дисперсные системы любого типа, полученные в концентрированном состоянии, также относят к связнодисперсным системам. В концентрированных дисперсных системах независимое движение частиц дисперсной фазы затруднено, и для них характерна некоторая степень структурированности, что и позволяет их рассматривать как связнодисперсные системы. Эффект Тиндаля,—оптический эффект, рассеяние света при прохождении светового пучка через оптически неоднородную среду. Обычно наблюдается в виде светящегося конуса (конус Тиндаля), видимого на тёмном фоне.Характерен для растворов коллоидных систем(например,золей,металлов, разбавленных латексов,табачного дыма), в кот ч-цы и окруж их среда разл-ся по показателю преломления. На эффекте Тиндаля основан ряд оптич методов опред размеров,формы и конц колл ч-ц и макромол. Бро́уновское движе́ние — беспоряд движение микроскоп видимых, взвешенных в жидкости или газе ч-ц тв в-ва,вызыв тепл движением ч-ц жидкости или газа.Броуновское движение никогда не прекращается.Б.Д. связано с тепловым движением,но не следует смешивать эти понятия. Б.Д. явл-ся следствием и свидетельством существования теплового движения.Б.Д. происходит из-за того, что все жидкости и газы состоят из атомов или молекул— мельчайших частиц, которые находятся в постоянном хаотическом тепловом движении, и потому непрерывно толкают броуновскую частицу с разных сторон. 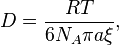
|
|
|
47 Адсорбция — увеличение концентрации растворенного вещества у поверхности раздела двух фаз.вследствие нескомпенсированности сил межмолекулярного взаимодействия на разделе фаз. Адсорбция является частным случаем сорбции, процесс, обратный адсорбции - десорбция Поглощаемое вещество, ещё находящееся в объёме фазы, называют адсорбтив, поглощённое— адсорбат. В более узком смысле под адсорбцией часто понимают поглощение примеси из газа или жидкости твёрдым веществом (в случае газа и жидкости) или жидкостью (в случае газа)— адсорбентом. При этом, как и в общем случае адсорбции, происходит концентрирование примеси на границе раздела адсорбент-жидкость либо адсорбент-газ. Процесс, обратный адсорбции, то есть перенос вещества с поверхности раздела фаз в объём фазы, называется десорбция. Если скорости адсорбции и десорбции равны, то говорят об установлении адсорбционного равновесия. В состоянии равновесия количество адсорбированных молекул остается постоянным сколь угодно долго, если неизменны внешние условия.Физическая адсорбция является обратимым процессом, условие равновесия определяется равными скоростями адсорбции молекул адсорбтива P на вакантных местах поверхности адсорбента S и десорбции— освобождения адсорбата из связанного состояния S–P. Уравнение Ленгмюра является одной из форм уравнения изотермы адсорбции. Под уравнением изотермы адсорбции понимают зависимость равновесной величины адсорбции от концентрации адсорбтива a=f(С) при постоянной температуре (T=const). Концентрация адсорбтива для случая адсорбции из жидкости выражается, как правило, в мольных либо массовых долях. Часто, особенно в случае адсорбции из растворов, пользуются относительной величиной: С/Сs, где С— концентрация, Сs— предельная концентрация (концентрация насыщения) адсорбтива при данной температуре. В случае адсорбции из газовой фазы концентрация может быть выражена в единицах абсолютного давления, либо, что особенно типично для адсорбции паров, в относительных единицах: P/Ps, где P— давление пара, P— давление насыщенных паров этого вещества. Саму величину адсорбции можно выразить также в единицах концентрации (отношение числа молекул адсорбата к общему числу молекул на границе раздела фаз). Для адсорбции на твёрдых адсорбентах, особенно при рассмотрении практических задач, используют отношение массы или количества поглощённого вещества к массе адсорбента, например мг/г или ммоль/г.Адсорбция— всеобщее и повсеместное явление, имеющее место всегда и везде, где есть поверхность раздела между фазами. Наибольшее практическое значение имеет адсорбция поверхностно-активных веществ и адсорбция примесей из газа либо жидкости специальными высокоэффективными адсорбентами. В качестве адсорбентов могут выступать разнообразные материалы с высокой удельной поверхностью: пористый углерод(наиболее распространённая форма—активированный уголь),силикагели,цеолиты а также некоторые другие группы природных минералов и синтетических веществ.
48. Получение лиофобных золей.Конденсационные методы. Из них наиболее распространены метод замены растворителя и метод химической конденсации. Пример первого метода – получение золя канифоли в воде, при этом к спиртовому раствору канифоли постепенно добавляют воду, растворимость канифоли снижается, и образуется лиофобный золь. Пример второго метода – получение золя гидроксида железа путём разложения хлорида железа кипячением раствора.Дисперсионный метод – разрушение до коллоидно-дисперсных частиц более крупных агрегатов.Пептизация – «расцепление» агрегатов, образовавшихся при коагуляции лиозоля, на отдельные мицеллы; процесс, обратный коагуляции. Возможна, если структура коллоидных частиц не изменена. коагуляция лиофобных золей По теории Пескова, устойчивость коллоида объясняется присутствием кроме дисперсной фазы и дисперсионной среды третьего вещества – стабилизатора, образующего вокруг коллоидной частицы сольватный слой. Этот процесс – лиофилизация коллоида. Этот процесс можно вызвать адсорбцией поверхностно-активных веществ на поверхности коллоидной частицы.По физической теории устойчивости и коагуляции электролитами между мицеллами существуют силы притяжения и отталкивания. Силы отталкивания действуют, когда диффузные слои мицелл перекрываются друг другом. Эти силы являются не просто кулоновским взаимодействием. Дерягин показал, что здесь проявляется расклинивающее давление. Притяжение мицелл друг к другу обусловлено Ван-дер-ваальсовыми силами.Коагуляция – это осаждение дисперсной фазы путём слипания частиц друг с другом. Наиболее важной является коагуляция под действием электролитов. Правила такой коагуляции:Коагуляцию может вызвать любой электролит.Минимальная концентрация электролита, с которой начинается коагуляция – порог коагуляции.Коагулирующим действием обладает тот ион электролита, который по знаку противоположен заряду гранулы мицеллы.Правило Шульце – Гарди: чем больше валентность иона, тем больше его коагулирующая способность.В ряду органических ионов коагулирующая способность возрастает с повышением адсорбционной способности.В ряду неорганических ионов с одинаковым зарядом их коагулирующая способность возрастает с уменьшением гидратации В момент начала коагуляции электрокинетический потенциал снижается до критической величины в 0,03 ВИоны, вызвавшие коагуляцию, всегда присутствуют в полученных осадках
Многочисленными исследованиями влияния электролитов на устойчивость гидрофобных золей установлено, что коагулирующее действие электролита зависит от заряда ионов. Коагуляция идет с заметной скоростью лишь при концентрации электролита, превышающей некоторое критическое значение, называемое порогом коагуляции. Выше этой концентрации скорость коагуляции растет с ростом концентрации, пока не достигнет некоторого предела, после которого перестает зависеть от концентрации электролита. Очевидно, что области быстрой коагуляции соответствует полная дестабилизация частиц дисперсной фазы. Сопоставление коагулирующего действия электролитов с их влиянием на электрокинетические свойства показало, что порог коагуляции соответствует уменьшению электрокинетического потенциала примерно до 30 мВ, тогда как приближение к области быстрой коагуляции ведет к падению z-потенциала до весьма малых значений. Уже из этого факта можно сделать вывод, что именно электростатическое отталкивание коллоидных частиц ответственно за устойчивость таких гидрозолей.Вместе с тем, наряду с общим уменьшением порога коагуляции с ростом валентности противоионов наблюдаются более слабые различия коагулирующих способностей ионов одной валентности — так называемые лиотропные ряды ионов,— связанные с различием их поляризуемости и гидратируемости.
49. ВМС-хар-ся высокой М.Любой ат или гр ат,вход в с-в цепи полимера-сост звеном.Составное звено,кот можно мысленно выд из полимера, получ при полимеризации мономера-мономерным звеном. Классификация ВМС. от происхождения:природные, искусственные и синтетические. Природные образ в природе в раст или жив орг-змах.(полисах,лигнин, белки,НК,натур каучук.) Искусственные получ обраб природных полимеров разл хим реаг.(целлюлозы, крахмала)
По хим стр-ю: карбоцепные, сод в осн цепи ат С; гетероцепные сод в осн цепи кроме ат С гетероатомы(ат азота,О и серы) элементорганические,сод ат С и ат эл-ов,кот изуч неорг химия. Синтетические -полимеры,получ в рез синтеза из низкомол в-в мономер.
Способы получения: полимеризация,поликонденсация и полиприсоед. Полимеризация- послед присоед мол НМВ мономера к акт-му центру, нах в конце растущей цепи. Поликонд -процесс синтеза полимеров из би- или полифункц мономеров сопров выдел побочных низкомол продуктов: воды, спиртов, галогеноводородов, аммиака и др.
По отношению к воде: Гидрофильные- полимеры пов-сть кот смачивается водой.Макромол сод в с-ве полярные гр:СООН,ОН, сульфо- аминогр,способны образ водор связи с мол воды.(синтет полимеры полиакриловая к-та и др).природные полимеры(целлюлоза,крахмал,шелк,желатин)и искусств(метилцеллюлоза, соли карбоксиметилцеллюлозы). Гидрофобные- полимеры макромол сод непол гр(полиакрилаты,смолы,
каучуки). от расположения ат в пр-ве: Линейные- полимеры макромол предст открытую цепь или вытянутую в линию послед-сть циклов. Разветвленные- полимеры макромол им форму цепи с ответвлениями. Сетчатые (трехмерные, сшитые) – полимеры с поперечными связями или единой простр сеткой.
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 384; Нарушение авторских прав?; Мы поможем в написании вашей работы!