
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 3. Панцири толщиной в несколько нанометров или пассивность металлов
|
|
|
|
Чудесное явление обнаружил М.В. Ломоносов в 1743 году. В своей «Диссертации о действии химических растворителей вообще» он описал его так: «При употреблении достаточно крепкого селитряного спирта для растворения металлов растворение быстро кончается, так как растворитель перестает действовать». Селитряный спирт – азотная кислота (HNO3).
Открытое им явление, впоследствии названное пассивностью металлов, очень сложно и, имея большое практическое значение, продолжает оставаться предметом многочисленных исследований.
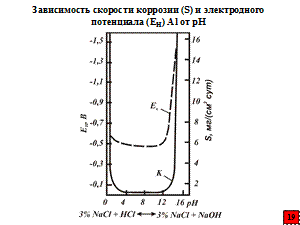
Пассивностью металлов называют состояние относительно высокой их коррозионной стойкости, когда с термодинамической точки зрения они являются вполне реакционно способными, вызванное торможением анодного процесса. Нельзя понятие «пассивность металлов» путать с понятием «пассивный человек». Пассивность металлов – электрохимическое явление. Высокая коррозионная стойкость может быть обусловлена различными причинами, в частности термодинамической устойчивостью, которой обладают в большем ряде случаев полублагородные и благородные металлы, особенно золото. Пассивность присуща, как правило, неблагородным металлам (металлам, имеющим очень отрицательный стандартный равновесный потенциал): танталу, титану, цирконию, ниобию, алюминию, хрому, молибдену, магнию, никелю, кобальту, железу и другим неблагородным металлам. Она наступает для каждого металла при различных условиях: концентрации окислителя в электролите, температуры, скорости движения водного раствора (электролита).
В атмосферных условиях присущий металлический блеск, вследствие очень низкой скорости коррозии, остается только у тех металлов и сплавов на их основе, которые пассивируются в этих условиях. К таким металлам, например, относится тантал, титан, цирконий, гафний, хром.
|
|
|
Наступление пассивного состояния металлических материалов характеризуется следующими явлениями:
а) резким уменьшением скорости растворения (коррозии) металла, которая в пассивном состоянии практически постоянна во времени;
б) значительным смещением потенциала металла в положительную сторону: для железа от значений –0,2-0,5 к значениям +0,5-1,0 В, для хрома от значений –0,4-0,6 до значений +0,9 В.
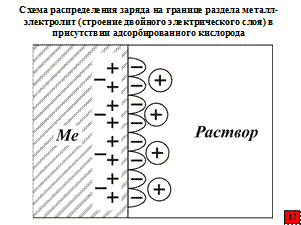
В 1836 г великий английский ученый Фарадей предложил пленочную теорию пассивности. Согласно этой теории пассивное состояние обуславливается присутствием на поверхности металлических материалов химически связанного кислорода.
Неблагородные металлы одеваются во многих, а точнее в окислительных, условиях в тончайший панцирь – твердое защитное образование, полностью или только частично покрывающее их тело (поверхность металла) и становятся «благородными». Толщина такого панциря не превышает нескольких десятков нанометров, а может быть всего несколько десятых долей нанометра. Выдающийся русский ученый-коррозиолог так описывает пассивную нанопленку: «доказано, что в ряде случаев заметное торможение анодного процесса может возникнуть уже при адсорбции на поверхности металла атомов кислорода в количестве менее одного монослоя». Например, по данным Б.В. Эршлера, покрытие 6 % поверхности платины адсорбированным кислородом смещает ее потенциал в растворе HCl в положительную сторону на 120 мВ и уменьшает при этом скорость анодного растворения этого металла в 10 раз. Адсорбированный кислород насыщает наиболее активные поверхностные атомы металлов и тем самым снижает его химическую активность.
В большинстве случаев предполагается образование мономолекулярных (моно – один) или полимолекулярных (поли – многочисленные) адсорбционных слоев, чаще всего хемосорбционных слоев кислорода.
|
|
|
Пассивность такого характера наблюдается на хроме, нержавеющих сталях, железе и других металлах. Толщина адсорбционных пассивных пленок составляет 0,1-0,5 нм (1·10-10 -5·10-10 м). Первичный хемосорбционный слой может утолщаться. Если панцирь закрывает всю поверхность металла, то с его утолщением переход металлических катионов в раствор (анодный процесс) будет затормаживаться в большей степени. Утолщенные защитные слои являются переходными от чисто адсорбционных к фазовым (например, к химическим соединениям: смешанный оксид Cr2O3 или CrO3 на хроме в кислых средах, Al2O3·H2O (бемит) или Al2O3·3H2O (гидрагилит) на алюминии). Тонкие пассивные нанопленки для отличия их от хемосорбционных слоев с одной стороны и фазовых с другой, целесообразно называть барьерными. Такие пассивирующие защитные «панцири» достигают толщин, соизмеримых с несколькими параметрами элементарных ячеек оксидов (их толщина от 5 до 100 нм (5·10-9 -5·10-7 м) и имеют аморфную или неявную кристаллическую структуру, или структуру, находящуюся в некотором ориентационном соответствии со структурой нижележащей металлической основы. Она обычно значительно отличается от структуры компактного оксида.
При повышении окислительной способности среды или смещения электродного потенциала в положительную сторону, что практически одно и тоже, как показал в своих работах академик Я.М. Колотыркин, происходит образование более толстых пленок, но внешний фазовый слой, как правило, пористый и менее защитный.
Образование «панциря» можно описать реакцией:
Ме + Ок- → МеОк + е,
где Ок- - анион окислителя, МеОк – хемосорбционная или барьерная нанопленка.
«Панцирь» - пассивная пленка- является разделяющим барьером между металлической основой и электролитом. Через него практически не переносятся (не диффундируют и не мигрируют) ионы, но он электропроводен, так как электроны легко проходят через него.
«Панцирь» остается на поверхности металлического материала только в определенных внешних условиях (состав, pH, температура, скорость движения электролита). Поэтому не всегда неблагородный металл превращается в «благородный».
|
|
|
Например, во всех водных нейтральных или слабокислых растворах не только при доступе кислорода или окислителей, но и в отсутствии окислителей алюминий обычно находится в пассивном состоянии (обладает способностью «надевать на себя панцирь»). Однако защитный «панцирь» амфотерен. Он растворяется как в сильных кислотах (неокисляющих), так и в щелочных растворах (особенно легко).
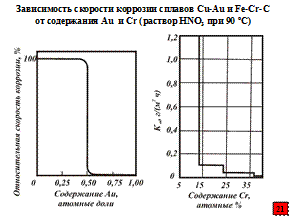
Увеличить способность металла одевать на себя «панцирь» (пассивироваться) можно за счет его легирования или смещения электродного потенциала в положительную сторону (анодная защита) при помощи внешнего источника тока или присоединения защищаемого металла к более благородному.
Именно благодаря легированию были получены и нержавеющие стали.
Мопнартц в Германии был, по-видимому, первым (1911 г), кто установил, что для придания железу (стали) высокой склонности к пассивированию, его необходимо легировать 12 % хрома. Позднее появилось правило n/8 Таммана. Тамман установил, что коррозионная стойкость гомогенных твердых растворов при легировании менее коррозионностойкого металла более стойким изменяется не непрерывно, а скачками. Резкое изменение коррозионной стойкости происходит, когда концентрация легирующего элемента достигает 1/8 атомной доли, или величины кратной этому числу, т.е. 2/8, 3/8, 4/8. При этом (по указанию А.И. Шултина) следует учитывать возможность обеднения твердого раствора легирующим элементом при связывании его другими компонентами сплава (например, связывание хрома углеродом в карбиды) и в связи с этим необходимость введения в сплав дополнительного количества легирующего элемента. Благодаря открытым явлениям и были разработаны широко известные нержавеющие стали Х18Н10 и Х18Н10Т. При этом Т – титан, добавляемый в нержавеющую сталь для борьбы с очень опасным видом коррозионной болезни сплавов, находящихся в пассивном состоянии – межкристаллитной коррозией, т.е. коррозией по границам зерен, которая приводит к потери или прочности и пластичности.
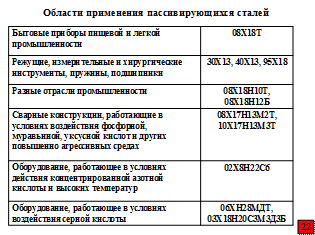
На схеме приведены легко пассивирующиеся марки сталей.
|
|
|
Одевшись в «панцирь», сплав, имеющий большую склонность к пассивации, в отличие от благородных металлов, может приобрести местные (локальные) виды коррозионной болезни: точечную (питтинговую), межкристаллитную, коррозионную усталость и растрескивание.
Общая коррозия представляет большой вред с точки зрения экономики, так как ответственна за основной объем корродируемого и коррозионно распыленного металла. Локальная коррозия более опасна в инженерно-техническом и социальном плане. Растрескивание – наиболее опасный вид коррозионной болезни металлов, несмотря на то, что количество прокорродировавшего металла может быть ничтожно мало. От растрескивания (коррозионное растрескивание и усталость, начинающиеся с питтинговой и/или межкристаллитной коррозии) пострадала военная авиация США во время войны во Вьетнаме. Если принять рабочий день самолета за 8 часов, то 22 часа в день американские военные тратили на защиту от коррозии. 25 % самолетов не могли летать, а часть из них терпела авиационные катастрофы из-за разрушения тяг рулевого управления, изготовленных из легкопассивирующегося сплава. Виной тому была большая влажность и наличие хлоридов в приморской атмосфере. Другой пример – знаменитая скульптура «Рабочий и колхозница», в которой один только шарф длиной 30 м и массой 5,5 т, сделан из нержавеющей стали, пассивирующейся в атмосферных условиях. Однако атмосферные условия в Москве таковы, что даже «нержавеющая» сталь стала болеть, первоначально местным видом коррозии. Огромный труд потребовался, чтобы восстановить эту уникальную структуру.
Но можно ли одеть стальные конструкции в более надежную «одежду»? Да. Разработано множество более толстых, чем пассивные нанопленки, защитные многофункциональные покрытия.



Тема 4. Большая четверка – сверхтугоплавкие металлы и их защита от газовой коррозии
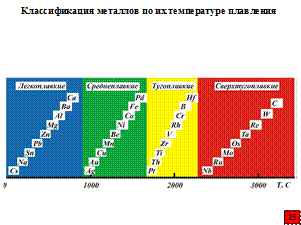
Среди высокотемпературных материалов большую роль играют так называемые тугоплавкие металлы. Что же обозначается этим термином? Анализ литературных данных показывает, что сколько-нибудь обоснованной и единой точки зрения по этому вопросу нет. Большинство считают, что к тугоплавким относятся металлы с температурной плавления, превышающей 1650 ºC. Другие ограничивают эту область металлами, температура плавления которых больше 2000 ºC, а некоторые называют даже границу 2500 ºC. По-мнению ряда специалистов в области высокотемпературного окисления тугоплавких металлов и сплавов на их основе металлы можно (по их температуре плавления) разделить на четыре группы:
I – легкоплавкие, Тпл ≤ 900 ºC;
II – среднеплавкие, Тпл = 900-1600 ºC;
III – тугоплавкие (включая B и Hf), Тпл = 1650-2300 ºС;
IV – сверхтугоплавкие, Тпл ≥ 2450 ºC.
Сверхтугоплавкие металлы имеют весьма высокое значение для современной техники и особенно для новых ее областей. Три металла – рутений, иридий и осмий – очень редки, дороги и не находят широкого применения. Что же касается молибдена, вольфрама, ниобия и тантала, то они все шире входят в практику, и благодаря важным свойствам, главным из которых является высокая жаропрочность, получили название большой четверки. В последние годы, несмотря на свою дороговизну и редкость, все большее значение начинает приобретать рений.
К сожалению, некоторые обстоятельства мешают внедрению сверхтугоплавких металлов в технику, и основным из них является низкая жаростойкость. Жаростойкостью называют способность материала, в том числе металлических материалов, сопротивляться коррозионному воздействию окислительной газовой среды при высоких температурах. Необходимо, чтобы металлические материалы, эксплуатирующиеся при высоких температурах, сочетали хорошую жаростойкость с высокой жаропрочностью. Жаропрочностью называют способность материалов сохранять при высоких температурах достаточно высокие механические свойства: длительную прочность и сопротивление ползучести.
Изделия из металлов, называемых большой четверкой, не могут применятся для работы при температурах, превышающих 650-850 ºC, в средах, содержащих кислород или другой окислитель, без специальной защиты. Работа по повышению жаростойкости ведется в двух направлениях: 1) повышение стойкости к газовой коррозии металлов легированием; 2) разработка защитных покрытий.
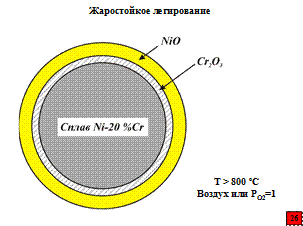
Первый путь – получение твердого раствора одного металла (Ме1) в другом (основном) металле (Ме2), при окислении которого при высоких температурах образуется высокозащитный слой из оксида легирующего элемента (Me1mOmn/2, где m – количество металла в оксиде, а n – степень его окисленности). Это основной путь для получения жаростойких сплавов на основе черных металлов: железо, никель, кобальт. Например, жаростойкость сплава Ni-20 % Cr, связана с образованием внутреннего оксидного слоя из Cr2O3 при высоких температурах (более 800 ºC) на воздухе или в кислороде при давлении газа 1 атм.
К сожалению, этот путь увеличения жаростойкости сплавов на основе металлов большой четверки и рения не явился перспективным (обнадеживающим).
Основные усилия коррозиологов в последние 50 лет направлены на разработку защитных покрытий.
Все жаростойкие покрытия, независимо от метода их нанесения и условий эксплуатации, должны, как минимум, удовлетворять следующим требованиям: 1) представлять собой надежный барьер для проникновения (диффузии) агрессивных компонентов внешней среды к защищаемому металлу; 2) иметь прочное сцепление с подложкой (основным металлом или сплавом на его основе) и хорошо противостоять тепловым ударам (циклам нагрев-охлаждение изделия с покрытием); 3) иметь удовлетворительные механические свойства (пластичность, прочность); 4) не ухудшать значительно механические свойства защищаемого металла; 5) обладать высокой степенью надежности, т.е. не образовывать дефектов, либо обладать способностью к их самозалечиванию; 6) не ухудшать значительно своих защитных свойств в результате взаимодействия с подложкой.
Существуют самые разнообразные покрытия и методы их нанесения на тугоплавкие металлы и сплавы на их основе. Остановимся только на наиболее широко применяемых покрытиях и методах их получения.
Газофазные методы диффузионного силицирования изделий из молибдена и вольфрама, а также сплавов на их основе получили большое распространение, как более простые по технологии. Газофазный порошковый метод имеет два технологических варианта: 1) безактивационный; 2) силицирование с активаторами.
Безактивационный: температура в контейнере 1250-1300 ºC; вакуум (1-5)·10-5 мм.рт.ст., размер частиц кремния 50-100 мкм, объем материала засыпки в 5 раз больше внутреннего объема контейнера, покрываемое изделие размещается в центре.
Силицирование с активаторами (галогены, например KF, K2SiF6): температура в контейнере 1000-1250 ºC; активатор 2-5 % от количества порошкообразного кремния; длительность процесса от 10 до 15 ч; толщина покрытия от 85 до 114 мкм. Защитные слои – MoSi2, WSi2, т.к. при их высокотемпературном окислении образуется по реакциям малопроницаемая для окислителя «броня» (пленка), состоящая в основном из SiO2.
2MoSi2(т) + 7O2(г) → 2MoO3(г) + 4SiO2(т);
2WSi2(т) + 7O2(г) → 2WO3(г) + 4SiO2(т).
Когда пленка из SiO2 полностью закроет всю поверхность изделия (MoO3, WO3 – летучие оксиды при высоких температурах), то благодаря низкой ее проницаемости реакция окисления дисилицидов идет по уравнениям:
5MoSi2 + 7O2 → Mo5Si3 + 7SiO2;
5WSi2 + 7O2 → W5Si3 + 7SiO2,
что приводит к утолщению «брони» из SiO2.
Металлопокрытия часто наносят горячим методом – окунанием изделий в металлический расплав и газофазными методами. Длительная работоспособность хромоникелевых покрытий является высокой (не менее 400 ч) только при температурах не превышающих 1100 ºC.
Для ответственных изделий специального назначения применяют и покрытия из благородных металлов. Например, покрытие из Ir, получаемое обмазкой с последующим спеканием, используют в качестве кратковременной защиты камер сгорания ракетных двигателей, изготавливаемых из жаропрочного сплава Ta-10 % W, до температуры 2200 ºC.
Наибольшее распространение покрытия на основе Pt, Rh и их сплавов получили для защиты Mo и W. При применении последних часто используют промежуточный слой из оксидов, в частности из Al2O3.
В ряде случаев, особенно на W наносят Ir и тугоплавкие оксиды: ZrO2, HfO2, ZrSiO4.
Покрытие из сплава Hf-20 % Ta обеспечивает защиту танталовых сплавов до 2100 ºC в течение времени, достаточного для работы ракетного двигателя.
В США производство листов из тугоплавких металлов с плакировкой из сплавов Hf-20 % Ta; Hf-20 % Ta-20 % Mo освоено в промышленном масштабе. Плакирование представляет собой процесс получения покрытия механическим способом. Металлические листы закрывают тонким слоем другого металла и проводят горячую прокатку.
При температурах, больших 1900 ºC, разрабатываются покрытия из тугоплавких соединений (оксиды: Al2O3, MgO, ThO2, HfO2, ZrO2; бориды: TiB2, ZrB2, HfB2, CrB2, которые более стабильны, чем силициды MoSi2, WSi2).
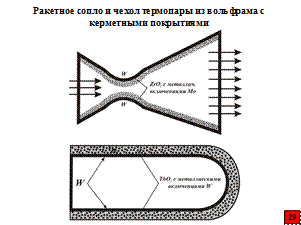
Например, керметное покрытие (смесь тугоплавкого соединения с металлом), состоящее из 10-25 % Mo или W и тугоплавкого оксида (ThO2, HfO2, ZrO2), нанесенное на W плазменным методом, используют для коррозионной и эрозионной защиты ракетных сопел. Металл, заключенный в керметном покрытии, увеличивает стойкость последнего к тепловым ударам (увеличивает термостойкость покрытия). Опыт эксплуатации вольфрамовых чехлов термопар с керметным покрытием W-ThO2, с увеличивающейся к поверхности концентрацией оксида, до температуры 2480 ºC показал, что чехлы термопар можно эксплуатировать длительное время даже при циклически изменяющихся температурах.
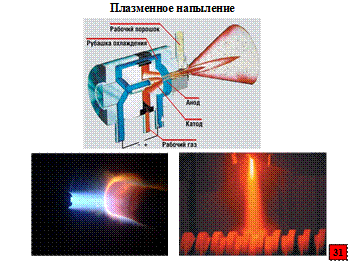
Широко применяемые плазменный и пламенный методы имеют одинаковый механизм нанесения покрытий на изделия. Однако при пламенном методе температура пламени (обычно кислородно-ацетиленового) не выше 2000 ºC, а при плазменном методе температура плазмообразующего газа может достигать 20000 ºC. Сущность этих методов – расплавленные частицы металла и/или химического соединения захватываются подаваемым под давлением потоком газа-носителя (воздух или инертный газ) и переносятся на поверхность покрываемого изделия. Скорость полета расплавленных частиц на выходе из сопла составляет при пламенном методе десятки, а при плазменном – сотни метров в секунду. Даже при плазменном напылении тугоплавких химических соединений и тонкостенных обрабатываемых деталях температура последних не поднимается выше 200-250 ºC. Плазменный метод более сложен в технологическом отношении, но дает более качественные покрытия по сравнению с пламенным. Кроме того, он, благодаря значительно более высокой температуре, охватывает более широкий ассортимент наносимых материалов.



|
|
|
|
|
Дата добавления: 2015-06-29; Просмотров: 574; Нарушение авторских прав?; Мы поможем в написании вашей работы!