
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гальванический элемент
|
|
|
|
ТЕОРЕТИЧЕСКИЕ ПОЯСНЕНИЯ
Гальванический элемент – химический источник тока: устройство, вырабатывающее электрическую энергию в результате прямого преобразования химической энергии окислительно-восстановительной реакции.
Электрический ток (направленное движение заряженных частиц) передается по проводникам, которые подразделяют:
- проводники первого рода (электронные проводники). К ним относятся все металлы и их сплавы, графит, уголь, а также некоторые твердые оксиды. Удельная электропроводимость (ом-1  см-1) этих проводников находится в пределах от 10 2 до 10 6 (уголь - 200,серебро - 6
см-1) этих проводников находится в пределах от 10 2 до 10 6 (уголь - 200,серебро - 6  105 и алюминий - 3,6
105 и алюминий - 3,6  105).
105).
- проводники второго рода (ионные проводники). Они характеризуются низкой электропроводностью [Н 2О - 4  10-8, С 2Н5ОН - 3
10-8, С 2Н5ОН - 3  10-6, 30% р-р Н2SO4 - 0,74, расплав NаCl (750 оC) – 3,4].
10-6, 30% р-р Н2SO4 - 0,74, расплав NаCl (750 оC) – 3,4].
Вещества, обладающие электропроводностью ниже 10-10ом-1  см-1 относятся к диэлектрикам (сера - 2 1
см-1 относятся к диэлектрикам (сера - 2 1  10-16, SiO2 - 5
10-16, SiO2 - 5  10-17).
10-17).
При сочетании проводников первого и второго рода образуется электрод. Это, чаще всего металл, опущенный в раствор собственной соли.
При погружении металлической пластинки в воду атомы металла, находящиеся в его поверхностном слое, под действием сильно полярных молекул воды гидратируются. В результате гидратации связь их с остальными атомами ослабляются и некоторое количество атомов, отрываясь от металла, переходит в виде гидратированных ионов в слой жидкости, прилегающий к поверхности металла: металлическая пластинка заряжается при этом отрицательно (см. рис.1а):
Me + mH2O 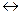 Men+
Men+  nH2O + ne –,
nH2O + ne –,
где Me – атом металла;
Men+  mH2O – гидратированный ион металла;
mH2O – гидратированный ион металла;
e - - электрон,
n - заряд катиона металла.
Состояние равновесия зависит от активности металла и от концентрации его ионов в растворе. В случае активных металлов, такие как Zn, Fe, Cd, Ni, взаимодействие с полярными молекулами воды оканчивается отрывом от поверхности положительных ионов металла и переходом гидратированных ионов в раствор. Этот процесс является окислительным. По мере увеличения концентрации катионов у поверхности становится вероятным обратный процесс- восстановления ионов металла. На границе «раствор-металл» создается двойной электрический слой.
|
|
|
При погружении металла не в воду, а в раствор соли этого металла равновесие смещается влево, то есть в сторону перехода ионов из раствора в металл. При этом устанавливается новое равновесие уже при другом потенциале заряда металла. Для неактивных металлов равновесная концентрация ионов металла в чистой воде очень мала. Если такой металл погрузить в раствор соли с большей концентрацией ионов этого металла, то в этом случае имеющиеся в растворе положительные ионы (катионы этого металла) выделяются на металле с большей скоростью, чем происходит переход ионов из металла в раствор.
а б

В этом случае поверхность металла получит положительный заряд, а раствор - отрицательный из-за избытка анионов соли (рис. 1б).
Таким образом, при погружении металла в воду или в раствор, содержащий ионы данного металла, на поверхности раздела металл - раствор образуется двойной электрический слой и возникает разность потенциалов между металлом и раствором. Потенциал каждого электрода зависит от природы металла, (активный или пассивный), концентрации его ионов в растворе и температуры.
Если металл опустить в раствор его соли с активностью ионов металла, равную единице, то такой потенциал называется стандартным электродным потенциалом.
Для смещения слоя электролита по отношении поверхности металла, необходимо потратить энергию равноценную разности потенциала на границе фаз. Абсолютные значения разности потенциалов (гальваны-потенциал) невозможно измерять, так как она возникает между двумя фазами разной природы (твердый металл / жидкий раствор). Однако можно измерить разность потенциалов двух химически различных электродов, приняв один из них за электрод сравнения (за ноль). В качестве такого электрода обычно используют водородный электрод 2H+/H2 (г.). Если потенциал стандартного водородного электрода { 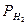 (на платине) = 101,325кПа; T=298K; а [H+] = 1моль/л} принять за нуль, и по сравнению с ним определить потенциал электрода, то получим ряд напряжения металлов, где металлы расположены слева на право по возрастанию стандартных электронных потенциалов. В ряду стандартных электронных потенциалов (T = 298K; P = 101,325кПа; а (1/nMen+ =1,0 моль/л) первым стоит литий (ЕLi+ /Li = - 3,0456 В) и последним золото (ЕAu + / Au = + 1,691 В).
(на платине) = 101,325кПа; T=298K; а [H+] = 1моль/л} принять за нуль, и по сравнению с ним определить потенциал электрода, то получим ряд напряжения металлов, где металлы расположены слева на право по возрастанию стандартных электронных потенциалов. В ряду стандартных электронных потенциалов (T = 298K; P = 101,325кПа; а (1/nMen+ =1,0 моль/л) первым стоит литий (ЕLi+ /Li = - 3,0456 В) и последним золото (ЕAu + / Au = + 1,691 В).
|
|
|
Сочетание двух элементов образует гальванический элемент.
ЭДС гальванического элемента определяют, как разность электродных потенциалов положительного (более благородного металла) и отрицательного электродов.
Зависимость электродного потенциала элемента (E) от температуры и концентрации (активности) электролита определяется уравнением Нернста.
Е = Е о+ (RT/nF)lnaMen+,
где Еo - стандартный электродный потенциал элемента, В;
R - универсальная газовая постоянная (R= 8.31 Дж/моль К);
Т - температура, К;
n- заряд катиона металла;
F- число Фарадея (заряд одной моли электронов: F=96500 кл/моль);
aMen+ - активность катионов металла в растворе, моль/л.
ЭДС любого элемента можно определить как разность электродных потенциалов катода и анода:
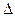 E = E+ - E- = (Eо+ - Eо-) + (0.059/n)lgа +/а-
E = E+ - E- = (Eо+ - Eо-) + (0.059/n)lgа +/а-
где - а + и а- - активность катионов металлов в растворах катодного и анодного отделений, соответственно.
Отрицательный полюс элемента называют анодом, так как на нем происходит процесс окисления:
Ме - nе- 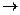 Ме n+
Ме n+
Положительный полюс называют катодом, так как на нем происходит процесс восстановления:
Меn+ + nе- 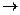 Ме
Ме
Гальванический элемент записывают в следующем порядке:
1. Электрод слева должен быть записан в последовательности металл-ион. Электрод справа записывается в последовательности ион-металл.



 Zn /Zn2+ //Cu2+ /Cu
Zn /Zn2+ //Cu2+ /Cu 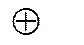
1. Реакция протекающая на левом электроде записывается как окислительная, а реакция на правом электроде – восстановительная.
|
|
|
2. Если 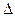 Е элемента >0, значит работа элемента будет самопроизвольна. Если
Е элемента >0, значит работа элемента будет самопроизвольна. Если 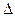 Е<0, то самопроизвольно будет работать обратный элемент (то есть надо поменять полюса).
Е<0, то самопроизвольно будет работать обратный элемент (то есть надо поменять полюса).
Электрический ток в виде направленного движения электронов движется по проводнику первого рода, соединяющему анод с катодом. Для обеспечения самопроизвольной работы элемента электролиты электродов необходимо соединить солевым мостом: - проводником второго рода (знак // в формуле записи элемента).
Солевой мост представляет из себя наполненный гелем (агар-агар) стеклянную трубку обе конца которой закрыты ватным тампоном. Мост выдерживают в насыщенном водном растворе сульфата натрия в результате чего происходит набухание гели раствором электролита и такая трубка превращается в электропроводник второго рода.
В ходе работы элемента на аноде происходит растворение металла, в результате чего в электролите увеличивается концентрация катиона металла, тогда как на аноде происходит ее уменьшение, так как на нем происходит восстановление металла.
Таким образом, в анодном пространстве образуется дефицит анионов, а на катодном - избыток. В результате образуется диффузионный потенциал, что приводит в движение анионов по солевому мосту с катодного - в анодное пространство.
Рассмотрим действие медно-цинкового элемента.
В U-образной трубке происходит электролиз воды: на левом электроде происходит восстановление водорода: 2Н2О + 2e- 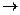 2OH- + H2, поэтому отрицательный электрод называют катодом. На положительном электроде электролизера происходит окисление воды с выделением кислорода, поэтому этот полюс называют анодом. 2 H2O - 4e -
2OH- + H2, поэтому отрицательный электрод называют катодом. На положительном электроде электролизера происходит окисление воды с выделением кислорода, поэтому этот полюс называют анодом. 2 H2O - 4e - 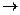 O2 + 4H+.
O2 + 4H+.
Как видно из уравнений, в электролизере в катодном отделении создается щелочная среда (рН > 7), а на анодном - кислая (рН < 7).
Если в раствор Na 2SO4 предварительно добавить фенолфталеин, то в ходе работы гальванического элемента в катодном отделении электролизера появится розовая окраска, что будет свидетельствовать о работе элемента. В этом можно убедиться и измерив ЭДС элемента (отклонение стрелки гальванометра). Для этого необходимо подключить вольтметр к полюсам элемента и измерить напряжение между катодом и анодом. При этом надо учесть, что согласно уравнению Нернста, ln(a+/ a-) = O (так как а + = а -) и максимальное значение ЭДС можно определить как разность стандартных электродных потенциалов катода и анода:
|
|
|
ЭДС = Е+о - Е о- = + 0,337 - (- 0,763) = 1,1 В.
Однако реальное значение ЭДС элемента всегда оказывается меньше теоретического, так как ни одно устройство не способно работать с КПД = 100%.
|
|
|
|
|
Дата добавления: 2015-06-29; Просмотров: 1698; Нарушение авторских прав?; Мы поможем в написании вашей работы!