
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения типовых задач
|
|
|
|
ХИМИЧЕСКОЕ СРОДСТВО
Примеры решения задач
Пример 1. Реакция горения жидкого этилового спирта выражается термохимическим уравнением:
C2H5OH(ж) + O2(г) = 2CO2(г) + 3H2O(ж); ΔH =?
Вычислите тепловой эффект реакции, если известно, что мольная теплота парообразования C2H5OH(ж) равна +42,36 кДж, а теплоты образования C2H5OH(г), CO2(г) и H2O(ж) соответственно равны, кДж/моль: -235,31; -393,51 и -285,84.
Решение. Для определения ΔH реакции необходимо знать теплоту образования C2H5OH(ж), находим ее из данных:
C2H5OH(ж) D C2H5OH(г); ΔH = +42,36 кДж
Из фазового перехода определим теплоту образования жидкого C2H5OH (ж):
+42,36 = -235,31 – ΔH C 2 H 5 OH(ж);
ΔH C 2 H 5 OH(ж) = -235,31 – 42,36 = -277,67 кДж
Вычислим ΔH реакции, применяя следствие из закона Г.И. Гесса:
ΔHoх.р = 2 ΔHoCO2(г) + 3 ΔH oH2O(ж) – ΔHo C 2 H 5 OH(ж)
ΔHoх.р. = 2(-393,51) + 3(-285,84) - (- 277,67) = -1366,87 кДж.
Вывод: реакция горения жидкого этилового спирта протекает с выделением большого количества тепла -1366,87 кДж.
Пример 1. Определите направление протекания при стандартных условиях реакции: Fe2O3(к) + 3H2(г) = 2Fe(т) + 3H2O(г)
Решение. Чтобы определить направление протекания реакции, нужно вычислить изменение стандартной энергии Гиббса
Согласно следствию из закона Гесса: ΔrG = ΣΔfG0кон – ΣΔfG0нач
Выпишем из табл.11 [] значения энергий Гиббса образования для всех участников реакции
| Fe2O3(к) | H2(г) | Fe(т) | H2O(г) | |
 , кДж/моль , кДж/моль
| –740,3 | –228,6 |
Отсюда ΔrG° = (2∙0 + 3∙-228,6) – (1∙-740,3 + 3∙0) = 54,5 кДж/моль.
Т.к. ΔrG > 0, в стандартных условиях эта реакция идет в обратном направлении.
Пример 2. Определите знаки DrН0, DrS0 и DrG0 для реакции
АВ(к)+ В2(г) = АВ3(к),
протекающей при 298 К в прямом направлении. Будет ли DG0 возрастать или убывать с ростом температуры?
|
|
|
Решение. Поскольку известно, что реакция протекает в прямом направлении, следовательно, ΔrG < 0.
В левой части уравнения 1 молекула газа (В2), а в правой части уравнения газа нет, следовательно, при протекании данной реакции энтропия системы уменьшается, т.е. ΔrS <0.
Поскольку DrН0, DrS0 и DrG0 реакции связаны друг с другом уравнением:
ΔrG0 = ΔrH0– T·ΔrS0,
то знак изменения энтальпии системы может быть только отрицательным: DНr<0.
Т.к. энтропийная составляющая данной реакции положительна, то с ростом температуры DrG будет возрастать, и выше некоторой температуры реакция будет протекать в обратном направлении.
Пример 3. При какой температуре начнетсяреакция:
С6Н6 (ж) + НNO3 (ж) = С6Н5NO2(ж) + Н2О (ж)?
При каких температурах реакция будет протекать в прямом, а при каких – в обратном направлении.
Решение. Температура начала реакции рассчитывается по формуле:
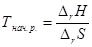
DrН0 и DrS0 рассчитывают по следствию из закона Гесса:
ΔrH = ΣΔfH0кон – ΣΔfH0нач
ΔrS = ΣS0кон – ΣS0нач,
используя значения энтальпий образования и абсолютных энтропий участников реакции из таблицы 11 []:
| С6Н6 (ж) | НNO3 (ж) | С6Н5NO2(ж) | Н2О (ж) | |
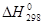 , кДж/моль , кДж/моль
| 49,03 | -173,00 | 15,90 | –285,83 |
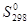 , Дж/моль К , Дж/моль К
| 173,26 | 156,16 | 224,26 | 69,95 |
ΔrH = (15,90-285,83) – (49,03-173,00) = -145,70 кДж
ΔrS = (224,26+69,95) – (173,26+156,16) = -35,21 Дж/ К = -0,035 кДж/ К.
Данная реакция начнется при температуре
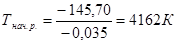 .
.
Поскольку в данной реакции энтальпийная составляющая отрицательная (DНr<0), а энтропийная – положительная(-Т ΔrS >0), то, в соответствии с уравнением:
ΔrG0 = ΔrH0– T·ΔrS0,
при Т>4162 К реакция будет идти в обратном направлении (ΔrG > 0), а при Т<4162 К - в прямом направлении (ΔrG < 0).
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 403; Нарушение авторских прав?; Мы поможем в написании вашей работы!