
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения типовых задач. Пример 1. Для определения относительной молекулярной массы вещества, являющегося незлектролитом, его навеска массой 1,764 г была растворена в воде
|
|
|
|
Пример 1. Для определения относительной молекулярной массы вещества, являющегося незлектролитом, его навеска массой 1,764 г была растворена в воде, и объем раствора доведен до 100 мл. Измеренное осмотическое давление раствора оказалось равным 2,38∙10 Па при 20оС. Рассчитайте молярную массу указанного вещества.
Решение. В растворе объемом 1 м3 масса вещества составляет 17640 г. Из уравнения Вант-Гоффа, подставляя в это выражение экспериментальные данные, получим:

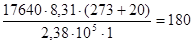 г/моль
г/моль
Пример 2. Навеска вещества массой 12,42 г растворена в воде объемом 500 мл. Давление пара полученного раствора при 25 0С равно 3297,8 Па. Как по этим данным найти молярную массу растворенного вещества?
Решение. Для определения молярной массы растворенного вещества М1 надо вычислить количество молей растворенного вещества ν1, пользуясь законом Рауля:
 ,
,
где: р - давление пара над раствором;
р0 – давление пара над чистой водой, его значение при 250С согласно табл 14 []
равно 3306 Па;
ν2 =  моль, после подстановки в закон Рауля получим:
моль, после подстановки в закон Рауля получим:
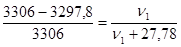 ; отсюда ν1 = ν(вещества) = 0,069 моль;
; отсюда ν1 = ν(вещества) = 0,069 моль;
М1 = 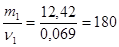 г/моль
г/моль
Пример 3. Раствор, содержащий 0,85 г хлористого цинка ZnС12 в 125 г воды, замерзает при —0,23 °С. Определите кажущуюся степень диссоциации хлористого цинка в этом растворе.
Решение. Выразим прежде всего моляльную концентрацию раствора в молях на 1000 г воды. Так как молярная масса хлористого цинка равна 136 г/моль, то
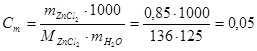 моль/кг
моль/кг
Для растворов электролитов величина понижения точки замерзания рассчитывается по формуле
∆t зам. = i∙ К∙Ст
Криоскопическая постоянная К для воды из табл.14[] равна 1,86, следовательно, изотонический коэффициент данного раствора составит:
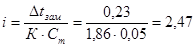
Степень диссоциации связана с величиной изотонического коэффициента соотношением:
|
|
|
 или 73,5%
или 73,5%
Здесь п – количество ионов, образующихся при диссоциации молекулы ZnCl2.
10. ИОННО-МОЛЕКУЛЯРНЫЕ РЕАКЦИИ ОБМЕНА
Примеры решения задач
Пример 1. ПР(РbSО4) = 2,2.10-8. Чему равна концентрация ионов Рb2+ и SО42- в насыщенном растворе сульфата свинца и его растворимость, выраженная молярной и массовой концентрациями?
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 670; Нарушение авторских прав?; Мы поможем в написании вашей работы!