
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Загальна характеристика методів редоксиметрії (оксидиметрії) або окисно-відновного титрування
|
|
|
|
План
Лабораторна робота №18
Приготування 250 мл розчину 0,1 моль/дм3 НСl приблизної концентрації
Алгоритм
Додаток 1

Тема: Редоксметрія. Визначення вмісту хлору у питній воді
1.Загальна характеристика методів редоксиметрії.
2. Індикатори методів окислення-відновлення
3. Грам-еквівалент у реакціях окиснення-відновлення.
4. Класифікація методів окисно-відновного титрування.
5. Методи визначення хлору.
Редоксиметрія – група методів кількісного хімічного аналізу, заснованих на застосуванні окисно-відновних реакцій. Для встановлення кінцевої точки титрування (точки еквівалентності) зазвичай в редоксиметрії використовуються специфічні хімічні індикатори: в йодометрії – крохмаль, в хроматометрії – дифеніламін, в церіметрії – ферроїн тощо. Застосування потенціометрії для встановлення точки еквівалентності значно розширює область редоксиметричних визначень. Редоксиметрія широко застосовується для аналізу неорганічних і органічних речовин і є найбільш поширеним видом титриметричних визначень.
Окисно-відновне титрування засноване на реакціях типу: aOx1 + bRed2 +... = bОx2 + aRed1 +..., де Ox1 і Ох2 - окислені форми відповідно титранта і визначуваної речовини, Red1 і Red2 - їх відновлені форми, a, b - стехіометричні коефіцієнти. Окисно-відновні потенціали, що характеризують титрант і визначувану речовину, відповідно мають вигляд:


де 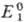 і
і  – реальні потенціали пар відповідно Ox1/Red1 і Ox2/Red2 в даній системі, n – число електронів, що беруть участь в реакції, F – число Фарадея, R – універсальна газова стала. Титрант діє як окисник, якщо
– реальні потенціали пар відповідно Ox1/Red1 і Ox2/Red2 в даній системі, n – число електронів, що беруть участь в реакції, F – число Фарадея, R – універсальна газова стала. Титрант діє як окисник, якщо  >
>  , і як відновник, якщо.
, і як відновник, якщо.  >
>  . В ході титрування величина |Е1-Е2| зменшується, а в точці еквівалентності Е1 = Е2.
. В ході титрування величина |Е1-Е2| зменшується, а в точці еквівалентності Е1 = Е2.
|
|
|
Титрування ефективне, якщо при цьому відношення [Red2]/[Ox2] (у випадку титрування окисником) або зворотне співвідношення (у випадку титрування відновником) мале. Для цього підбирають титрант так, щоб  було досить велике. Кінцеву точку встановлюють, як правило, потенціометрично або за допомогою окисно-відновних індикаторів, а також за появою або зникненням забарвлення титранта або речовини, яку титрують.
було досить велике. Кінцеву точку встановлюють, як правило, потенціометрично або за допомогою окисно-відновних індикаторів, а також за появою або зникненням забарвлення титранта або речовини, яку титрують.
В окисно-відновному титруванні (оксидиметрії) застосовують окисно-відновні реакції. При його проведенні речовина, що титрується, вступає в окисно-відновну реакцію з титрантом. Відмінною ознакою окисно-відновних реакцій (редокс-реакцій) є перенос електронів між реагуючими частинками – йонами, атомами, молекулами, комплексами, в результаті чого змінюється ступінь окиснення реагуючи частинок, наприклад: Fe2+ – ē = Fe3+.
Оскільки електрони не можуть накопичуватися в розчині, одночасно повинні проходити два процеси – втрати і придбання електронів, тобто, процес окиснення одних і відновлення інших частинок. Таким чином, будь-яка окисно-відновна реакція завжди може бути представлена в у вигляді двох напівреакцій.
Вихідна частинка і продукт кожної напівреакції складає окисно-відновну пару чи систему. Переміщення електронів при проходженні окисно-відновної реакції приводить до виникнення потенціалу. Потенціал, виміряний у В, є мірою окисно-відновної здатності сполуки. В якості донорів або акцепторів електронів можуть бути не лише частинки, які знаходяться в розчині, але і електроди. В цьому випадку окисно-відновна реакція відбувається на межі електрод – розчин і називається електрохімічною. Для кількісної оцінки окисних (відновних) властивостей системи в розчин занурюють електрод з хімічно інертного (індиферентного) струму провідного матеріалу. На межі розділу фаз (електрод – розчин) відбувається електронообмінний процес, який веде до виникнення електродного потенціалу, який є функцією активності електронів в розчині. Значення потенціалу тим більше, чим більша здатість розчину окиснювати. Отже, окисно-відновне титрування ґрунтується на тому, що аналізована речовина може існувати у двох формах – відновленій (наприклад, Fe2+) і окисненій (Fe3+). Визначеному співвідношенню цих форм відповідає певний потенціал розчину, який визначається рівнянням Нернста. У процесі титрування, наприклад, розчином окисника, відновлена форма аналізованої речовини переходить в окиснену форму зі зміною потенціалу системи. У точці еквівалентності аналізована речовина повністю переходить в окиснену форму і відбувається різка зміна потенціалу. Такий стрибок потенціалу свідчить про досягнення точки еквівалентності. Для кількісного аналізу підходять тільки ті реакції, які:
|
|
|
а) протікають швидко і до кінця (є практично необоротними);
б) утворюють продукти певного складу – реакція протікає стехіометрично;
в) не вступають у побічні реакції – титрант реагує тільки з визначуваним компонентом розчину;
г) дозволяють фіксувати точку еквівалентності.
Необхідною умовою придатності реакції є можливість визначення точки еквівалентності. Для цього різниця електродних потенціалів окисника і відновника повинна бути не меншою, ніж 0,4-0,5 В. Інакше реакція не проходить до кінця, або при титруванні відсутній відповідний різкий стрибок потенціалу поблизу точки еквівалентності. Індикація кінця титрування стає практично неможливою. В окисно-відновному титруванні є можливості регулювання потенціалів титранта і речовини, яку визначають. Для цього використовують зміну рН середовища, комплексоутворюючі добавки, збільшення температури тощо. Завдяки великому наборові титрантів і можливості регулювання процесу титрування, методами оксидиметрії аналізують багато різноманітних речовин.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 2923; Нарушение авторских прав?; Мы поможем в написании вашей работы!