
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение конца реакции
|
|
|
|
Йодометрия
Перманганатометрия
Оксидиметрический метод анализа, в котором в качестве рабочего используют раствор перманганата калия, называют перманганатометрией.
В основе метода лежит реакция окисления раствором KMnO4:
MnO4- + 5e + 8H+ ® Mn2+ + 4H2O.
Из реакции видно, что среда сильно кислая и так как в реакции участвует 5 электронов, число эквивалентов для MnO4- и Mn2+ равно 5.
При окислении в нейтральной или щелочной среде Mn7+ восстанавливается до Mn4+ и образуется MnO2 - тёмно-бурый осадок, который загрязняет раствор и затрудняет определение конца реакции.
Кроме того, стандартный потенциал пары MnO4- / Mn2+=1,51 В (в сильно кислом растворе ещё больше), а у пары MnO4- / MnО2=0,59 В. Следовательно, окислительная способность перманганата в кислой среде значительно больше, чем в щелочной.
При титровании в сильно кислых средах чаще всего используют серную кислоту. Соляную и азотную применять не следует, так как в их присутствии могут идти конкурирующие окислительно-восстановительные реакции.
Конец титрования в перманганатометрии определяют без индикатора, так как обесцвечивавщийся до точки эквивалентности MnO4- за счёт образования Mn2+, в точке эквивалентности окрашивает раствор в розовый цвет.
Йодометрический метод анализа основан на окислительно-восстановительных процессах, связанных с восстановлением I2 до I--ионов или с окислением I--ионов до I2:
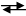 I2 + 2e 2I- восстановление (1)
I2 + 2e 2I- восстановление (1)
окислитель иодид-ион
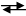 2I- - 2e I2 окисление (2)
2I- - 2e I2 окисление (2)
восстановитель
Йод, выделившийся в результате окисления йодид-ионов, титруют тиосульфатом натрия:
2S2O32- + I2 = S4O62- + 2I- (3)
Реакция (3) относится в йодометрии к числу важнейших.
Стандартный потенциал I2/2I- равен 0,54 В. Те вещества, потенциал которых больше 0,54 В окисляют ионы I- по уравнению (2). К таким окислителям относятся KMnO4, K2Cr2O7, Cl2 и др. Те вещества, у которых потенциал меньше 0,54 В окисляются йодом по уравнению (1). К таким восстановителям относятся Na2S2O3, SnCl2, Na2SO3, Na2S и др.
|
|
|
Для того чтобы наиболее полно прошла реакция между ионами ода и окислителем, необходимо потенциал системы окислителя увеличивать, а потенциал системы I2/2I- уменьшать. Если окислителем являются ионы содержашие кислород (MnO4-, Cr2O72-, AsO43- и др.), то реакцию необходимо вести в кислотной среде, так как с увеличением концентрации ионов Н+ потенциалы таких систем увеличиваются.
Потенциал системы I2/2I- не зависит от концентрации ионов Н+, а зависит от соотношения концентраций окисленной и восстановленной форм. Это видно и уравнения Нернста:
 . (4)
. (4)
Чтобы понизить потенциал системы I2/2I-, нужно увеличить концентрацию ионов I- и уменьшить концентрацию I2.
Таким образом, при определении окислителей необходимы следующие условия:
1. Кислотная среда.
2. Избыток ионов йода (I-).
3. Уменьшение концентрации свободного йода.
Для того чтобы наиболее полно прошла реакция между свободным йодом и восстановителем, необходимо потенциал системы восстановителя уменьшить, а потенциал системы I2/2I- увеличить. Для уменьшения потенциала системы восстановителя, содержащего кислород, нужно уменьшить концентрацию ионов Н+, т. е. вести реакцию в щелочной среде. Чтобы увеличить потенциал системы I2/2I-, нужно увеличить концентрацию I2 и уменьшить концентрацию I-.
Таким образом, при йодометрическом определении восстановителей необходимы следующие условия:
1. Щелочная среда (но не больше рН 8).
2. Отсутствие избытка ионов йода (I-).
3. Избыток свободного йода.
В йодометрии измерение количества йода, выделяемого окислителем или поглощаемого восстановителем, производят титруя его раствором тиосульфата. При этом протекает следующая реакция:
|
|
|
 2S2O32- - 2e = S4O62- H2S2O3 - тиосерная кислота
2S2O32- - 2e = S4O62- H2S2O3 - тиосерная кислота
тиосульфат-ион тетратионат-ион
 I2 + 2e = 2I- H2S4O6 - тетратионовая кислота
I2 + 2e = 2I- H2S4O6 - тетратионовая кислота
2S2O32- + I2 = S4O62- + 2I-
Титрование можно проводить без применения индикатора по обесцвечиванию йода или по появлению его жёлтой окраски. Для повышения чувствительности применяют специфический индикатор - крахмал. Крахмалом можно обнаружить ничтожно малые количества йода, на порядок меньше, чем по собственной окраске йода. Свободный йод окрашивает крахмал в интенсивно-синий цвет. При этом образуется адсорбционное соединение коллоидных частиц крахмала с йодом.
При титровании крахмал надо приливать вблизи точки эквивалентности, когда большая часть йода уже оттитрована и титруемый раствор из красно-бурого перешёл в светло-жёлтый. Если крахмал прибавлять раньше, то большое количество йода будет адсорбировано крахмалом и реакция йода с тиосульфатом замедлится.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 244; Нарушение авторских прав?; Мы поможем в написании вашей работы!