КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Силикаты определяют в виде кремниевой кислоты
|
|
|
|
Применение гидролиза
1. Необратимый гидролиз Al2S3, Cr2S3, TiS2 приводит к образованию осадков соответствующих гидроксидов Al(OH)3 , Cr(OH)3, Ti(OH)4.
2. Характерные реакции открытия катионов и анионов, например, Be, Bi, Sb. Так в результате гидролиза Bi3+ образуется белый осадок хлористого висмутила
BiCl3 +2HOH ↔ Bi(OH)2Cl+2HCl и далее
Bi(OH)2Cl ↔ BiOCl↓+H2O.
SiO32–+2HOH ↔ H2SiO3↓+2OH–. Для усиления гидролиза добавляют кислоту и NH4Cl и нагревают.
3. Регулирование кислотности и щелочности р-ров. (Для увеличения pH добавляют CH3COONa, для уменьшения – NH4Cl).
Теории кислот и оснований
Классическое понятие кислот и оснований было введено Аррениусом. Кислоты – вещества, при диссоциации (ионизации) молекул которых в воде образуются катионы водорода Н+ (H2SO4). Основания – вещества, при диссоциации молекул которых в воде образуются гидроксил анионы ОН–(NaOH). Реакция нейтрализации сводится к образованию молекул (растворителя) воды.
С накоплением экспериментального материала было установлено, что некоторые вещества, например, соли проявляют кислотные или основные свойства, а в реакции нейтрализации не образуются молекулы растворителя. Наиболее ярко это проявляется в неводных растворителях. Например, NH4Cl в жидком аммиаке ведет себя как кислота; мочевина в жидком аммиаке – кислота, а в безводной уксусной кислоте – основание; HNO3 в жидком HF и безводной H2SO4 – основание.
В связи с этим Brönsted и Lowry предложили (1923) протолитическую теорию (теорию переноса протона) кислот и оснований: кислоты – вещества (или ионы), способные отдавать протоны (доноры протонов); основания – вещества (или ионы), способные принимать, получать протоны (акцепторы протонов). Кислоты делят на нейтральные, катионные и анионные. Каждая кислота имеет сопряженное основание и наоборот. Пару кислота-основание называют сопряженной парой.
|
|
|
А(кислота) ↔ Н+ + В(основание).
Реакция нейтрализации сводится к образованию новых кислот и основания.
А1 + В2 ↔ В1 + А2
Вещества, способные как отдавать, так и принимать протоны называются амфипротонные, например, Н2О, NH3. Они одновременно являются и кислотами, и основаниями.
Электронная теория кислот и оснований предложена Lewis. Кислоты – вещества (или ионы) способные принимать свободную пару электронов. Например, у атома алюминия в возбужденном состоянии электронная конфигурация:
13Al[Ne] 3s13p2 ↑↑↑ _.
3s 3p
Три гибридные sp2 орбитали могут участвовать в образовании ковалентных связей, например, с атомами хлора, как в AlCl3. Свободная 3p орбиталь может быть использована для образования ковалентной связи по донорно-акцепторному механизму.
Основание ‑ вещества (или ионы), способные отдавать свободную пару электронов (NH3).
Примеры кислот и оснований по различным теориям приведены в табл.5.
Таблица 5
| Автор | Кислота | Основание | |||||||
| Arrhenius | H2SO4↔H+ + HSO4– | NaOH ↔OH– + Na+ | |||||||
| Brönsted, Lowry | 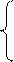 HCl
Нейтральные CH3COOH
кислоты H2O HCl
Нейтральные CH3COOH
кислоты H2O
H3O+ Катионные NH4+ кислоты [Al(H2O)6]3+
Анионные HCO3− кислоты H2PO4− | ↔ H+ + ↔ H+ + ↔ H+ + ↔ H+ + ↔ H+ + ↔ H+ + ↔ H+ + ↔ H+ + | Cl− CH3COO– OH– H2O NH3 [Al(H2O)5OH]2+ CO32− HPO42− | ||||||
| Lewis |    F F
 F B
F
Cl F B
F
Cl
 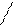
  Al
Cl Cl Al
Cl Cl
|  H H
   H N:
H H N:
H
| |||||||
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 243; Нарушение авторских прав?; Мы поможем в написании вашей работы!