
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Применение буферных растворов
|
|
|
|
Буферные системы широко используются в аналитике для проведения реакций окисления-восстановления, осаждения сульфидов, гидроокисей, карбонатов, хроматов, фосфатов и т.д., например:
1. Ацетатный буфер (pH≈5) применяют для осаждения осадков, не осаждаемых в кислых или щелочных растворах.
1.1. Ионы Ba2+ образуют с хромат ионами в присутствии Sr2+ и Ca2+ осадок BaCrO4 при этом ионы Sr2+ и Ca2+ остаются в растворе.
1.2. Для селективного окисления I– в присутствии Br– и Cl–
2. Формиатный буфер (HCOOH+HCOONa, pH ≈ 2) применяют при отделении ионов цинка, осаждаемых в виде ZnS в присутствии ионов Co2+, Mn2+, Ni2+, Fe2+, Al3+, Cr3+.
3. Аммиачно-аммонийный буфер (pH ≈ 9) используют при осаждении сульфидов Ni2+, Co2+, Zn2+, Mn2+ и т.д.
Способы выражения составов многокомпонентных систем (смесей)
1. Мольная доля xi (процент): отношение числа молей i -ого компонента ni к общему числу молей системы ∑ni
 ;
;  .
.
Число молей определяется массой mi и молярной массой Mi i -ого компонента
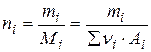 ,
,
где νi – число атомов с массой Ai в молекуле i -ого компонента.
2. Массовая доля ωi (процент): отношение массы i -ого компонента mi к массе системы в целом ∑mi
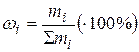 .
.
3. Объемная доля φi (процент): отношение объема i -ого компонента Vi к объему системы в целом ∑Vi
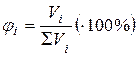 .
.
4. Молярность раствора ci: число молей i -ого компонента ni в литре раствора
(Vр-ра(л) – объем раствора в литрах)
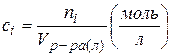 .
.
5. Моляльность раствора mi: число молей i -ого компонента ni на килограмм растворителя (Gр-ля(кг) – масса растворителя в килограммах)

6. Нормальность раствора Ni: число молей эквивалентов i -ого компонента nэi в литре раствора (Vр-ра(л) – объем раствора в литрах)

Число молей эквивалентов nэi определяется массой mi и массой моля эквивалентов Эi i -ого компонента
|
|
|
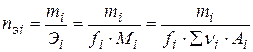 .
.
fi – фактор эквивалентности (≤ 1) равен для:
- кислот и оснований 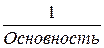 ;
;  ;
;  ;
;
- солей 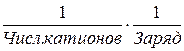 ;
; 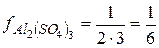 ;
;
- окислителей и восстановителей  ;
;  .
.
7. Титр раствора Тi: масса растворенного i -ого вещества в граммах mi в миллилитре раствора (Vр-ра(мл) – объем раствора в миллилитрах):
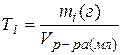 .
.
8. Титр i -ого титранта по k -ому определяемому веществу 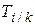 : масса определяемого вещества в граммах, эквивалентная массе, содержащейся в одном миллилитре титранта:
: масса определяемого вещества в граммах, эквивалентная массе, содержащейся в одном миллилитре титранта:
 .
.  .
.
Гетерогенное равновесие
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 390; Нарушение авторских прав?; Мы поможем в написании вашей работы!