
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотно-основное титрование
|
|
|
|
Титриметрический анализ
Основан на определении объемов растворов (взаимодействующих веществ), концентрация одного из которых известна.
По используемым реакциям различают:
1. Методы кислотно-основного титрования (нейтрализации)
Определяют кислоты, щелочи, гидролизующиеся соли. Используются индикаторы, изменяющие окраску в зависимости от рН среды.
2. Методы окисления-восстановления (редоксиметрия)
- перманганатометрия, рабочий раствор КМnО4 является окислителем; определяют Fe2+, NO2−, CNS−;
- йодометрия, рабочий раствор I2 – окислитель, вспомогательный раствор KI – восстановитель; определяют KMnO4, MnO2, Cl2, Na2SO3 Cu2+;
- хроматометрия, K2Cr2O7 – окислитель;
- броматометрия, KВrO3 – окислитель;
- ванадатометрия, рабочий раствор NH4VO3 – окислитель;
- цериметрия, окислитель и рабочий раствор − соединия Се (IV).
3. Методы осаждения – определяемый элемент переходит в осадок.
По применяемому рабочему раствору существует
- аргентометрия (AgNO3);
- роданометрия (NH4CNS);
- меркурометрия (Hg22+).
4. Методы комплексообразования.
Основаны на образовании комплексных ионов. Используются комплексоны (трилон Б).
Способы титрования:
1) прямого титрования;
2) обратного титрования (избытка);
3) замещения.
Исходные и рабочие титрованные растворы
Титрованные растворы – растворы с точно известной концентрацией. Первичный стандартный (исходный) раствор готовят из веществ, которые должны удовлетворять ряду требований.
В качестве веществ для исходных растворов обычно применяют буру
Na2B4O7·10H2O, щавелевую кислоту H2C2O4·2H2O, оксалат натрия Na2C2O4, янтарную кислоту H2C4H4O4, KCl, NaCl, K2Cr2O7, Na2CO3 и т.д.
В качестве вторичных стандартных растворов, которые называют также рабочими растворами или титрантами, применяют H2SO4 (стандартизируют по тетраборату натрия), КОН (стандартизируют по щавелевой кислоте), Na2S2O3 (стандартизируют по дихромату калия) и т.д.
|
|
|
| Требования к веществам |
| Чистые | Состав соответствует формуле |
| Устойчивы | Большая эквивалентная масса |
Таким образом в титриметрии существует следующая последовательность определения характеристик растворов: первичный стандартный → вторичный стандартный (титрант) → исследуемый раствор.
Основная реакция: Н+ + ОН− → Н2О или Н3О+ + ОН− → 2Н2О.
Первичные стандартные растворы:
I. Для стандартизации кислот
1.1. 0,1н р-р Na2B4O7·10H2O – тетраборат натрия (бура).
Реакции: Na2B4O7 + 7Н2О ↔ 2NaOH + 4Н3ВО3 – гидролиз, +
2NaОН + 2НСl → 2NaCl + 2Н2О – титрование;
Na2B4O7 + 2HCl + 5H2O → 4H3BO3 + 2NaCl − итоговое уравнение
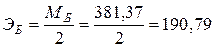 г/экв.
г/экв.
1.2. 0,1н р-р Na2CO3 – безводный карбонат натрия.
 г/экв.
г/экв.
II. Для стандартизации щелочей
2.1. 0,1н р-р Н2С2О4·2H2O – щавелевая кислота.
Реакция: Н2С2О4 + 2NaOH Na2С2О4 + 2H2O
 г/экв.
г/экв.
2.2. 0,1н р-р Н2С4Н4О4 – янтарная кислота
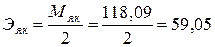 г/экв.
г/экв.
| Вторичные стандартные растворы | 1. 0,1н р-р HCl или 0,1н р-р H2SO4 для определения щелочей; 2. 0,1н р-р КОН или 0,1н р-р NaOH для определения кислот. | ||
| ФиксированиеточкиэквивалентностиТЭ | Кислотно-основные индикаторы, меняющие окраску в интервале рН, называемом интервалом перехода рТ=рКii1, совпадающем с областью скачка титрования на кривой титрования | ||
| 1. Метиловый оранжевый | Красный - желтый | 3,14,4 | рKii 3,7 |
| 2.Бромтимоловый голубой | Желтая – голубая | 6,07,6 | pKii 7,0 |
| 3. Фенолфталеин | Бесцветный – малиновый | 8,310,0 | рKii 9,4 |
| Определяемые вещества | Кислоты, НСl; Основания, NaOH; Соли, гидролизующиеся в водных растворах, аммония, Na2CO3, и т.д. |
Расчет кривой кислотно-основного титрования
1. Сильная одноосновная кислота титруется сильной одноосновной щелочью.
Пусть к 20 мл 0,1н HCl приливают 0,1н NaOH
|
|
|
(HCl+NaOHNaCl+HOH)
1.1. Начальная точка.
Объем добавленной щелочи Vщ = 0 рН = -lg(0,1γ±) = -lg(0,10,796) = 1,10.; без учета γ± pH = -lg0,1 = 1,00.
1. Прилили (+) 18 мл NaOH. Не прореагировало 2 мл 0,1н HCl.
За счет разбавления концентрация кислоты стала (N1V1 = N2V2)
 . рН = 2,28.
. рН = 2,28.
1.3. + 19,8 мл NaOH. Не прореагировало 0,2 мл 0,1н НСl.
 . pH = 3,30.
. pH = 3,30.
1.4. + 20 мл NaOH. Полная нейтрализация. Конечная точка титрования (КТТ). рН = 7,00.
1.5. + 20,2 мл NaOH. Не прореагировало 0,2 мл 0,1N NaOH. За счет эффекта разбавления.
 . pH = 14,0−рОН = 14,0−3,30 = 10,7.
. pH = 14,0−рОН = 14,0−3,30 = 10,7.
1.6. + 22 мл NaOH. Не прореагировало 2 мл 0,1N NaOH.
 . pH = 14,0-2,32 = 11,7.
. pH = 14,0-2,32 = 11,7.
1.7. + 40 мл NaOH. Не прореагировало 20 мл 0,1 NaOH.
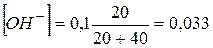 . pH = 14,0-1,48 = 12,5.
. pH = 14,0-1,48 = 12,5.
Полученные данные удобно свести в таблицу
| Объем щелочн. Vщ, мл | 19,8 | 20,2 | |||||
| pH раствора | 1,00 | 2,28 | 3,30 | 7,00 | 10,7 | 11,7 | 12,5 |
Строим кривую титрования в координатах рН=f (Vщ) (рис.1 а).
Особенности случая:
1. Точка эквивалентности лежит на кривой титрования.
2. Имеет место большой скачок рН на кривой титрования (410).
3. Применимы кислотно-основные индикаторы, показатель титрования рТ которых лежит в области скачка титрования (рН=410).
рТ ~ рKii 1. Kii − константа ионизации индикатора. Подойдут индикаторы:
· метиловый оранжевый 3,14.4;
· метиловый красный 4.26.3;
· бромтимоловый голубой 6,07,6;
· фенолфталеин 8,310,0.
2. Слабая одноосновная кислота титруется щелочью.
Пусть 20 мл 0,1N CН3СООН титруют 0,1N NaOH.
По мере титрования до точки эквивалентности имеем буферную смесь (слабая кислота + соль), в которой количество кислоты уменьшается, а соли увеличивается. Для кислого буфера 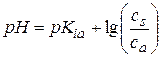 . Для СН3СООН
. Для СН3СООН
pKia =4,76.
2.1. Vщ =0.  .
.
2.2. + 5 мл NaOH. Осталось 15 мл 0,1н непрореагировавшей кислоты. С учетом разбавления ее концентрация 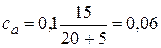 моль/л. Образовалось соли CH3COONa
моль/л. Образовалось соли CH3COONa  моль, ее концентрация
моль, ее концентрация  моль/л.
моль/л. 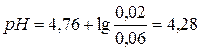 .
.
2.3. + 10 мл NaOH. Осталось 10 мл кислоты.  моль/л.
моль/л.
Образовалось соли  моль,
моль,  моль/л.
моль/л.
 .
.
2.4. + 18 мл NaOH. Осталось 2 мл кислоты.  моль/л.
моль/л.
 моль/л,
моль/л, 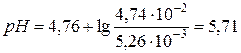 .
.
2.5. + 19,8 мл NaOH. Осталось 0,2 мл кислоты.  моль/л,
моль/л,  моль/л,
моль/л,  .
.
2.6. + 20 мл NaOH. В точке эквивалентности имеем соль (ацетат натрия), гидролизующуюся по аниону, концентрация которой
 моль/л.
моль/л.
 ,
,  ,
,
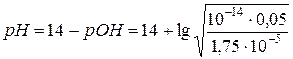 =8,73.
=8,73.
2.7. + 20,2 мл NaOH. Избыток NaOH 0,2 мл. Концентрация основания
 , рН = 10,7.
, рН = 10,7.
2.8. + 22 мл NaOH. Избыток 2 мл NaOH, [OH−] =
 моль/л, рН = 11,7.
моль/л, рН = 11,7.
|
|
|
2.9. + 40 мл NaOH. Избыток 20 мл NaOH, [OH−] =
 моль/л, рН = 12,5.
моль/л, рН = 12,5.
Полученные данные сведем в таблицу
| Объем щелочи, Vщ, мл | 19,8 | 20,2 | |||||||
| pH раствора | 2,88 | 4,28 | 4,76 | 5,71 | 6,76 | 8,73 | 10,7 | 11,7 | 12,5 |
Строим кривую титрования в координатах рН=f (Vщ).
Особенности случая:
1. Точка эквивалентности лежит в щелочной области (pH=8,73).
2. Скачок титрования относительно небольшой, от рН=8 до рН=10.
3. Начальная точка лежит в менее кислой области (pH=2,88).
Применим только фенолфталеин в качестве индикатора, так как рТ других лежит вне зоны скачка рН.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 489; Нарушение авторских прав?; Мы поможем в написании вашей работы!