
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ТЕМА: Анализ качества лекарственных средств из группы углеводов (моно-, олиго- и полисахариды) и их синтетических аналогов
|
|
|
|
ЗАНЯТИЯ № 1-2
Смысловой модуль 2.1. – «Лекарственные средства из группы углеводов, сердечных гликозидов, терпенов и их синтетических аналогов».
КОНКРЕТНЫЕ ЦЕЛИ:
- Усвоить свойства лекарственных средств из группы углеводов, гликозидов и терпенов.
- Знать основные источники и методы получения лекарственных средств из группы углеводов, гликозидов и терпенов.
- Предлагать и осуществлять выбор физических, физико-химических и химических методов анализа качества лекарственных средств из группы углеводов, гликозидов и терпенов согласно требованиям ГФУ, аналитической нормативной документации (АНД), а также методик контроля качества (МКК).
- Объяснять особенности проведения анализа лекарственных средств из группы углеводов, гликозидов и терпенов с использованием физических, физико-химических и химических методов.
- Трактовать результаты исследований лекарственных средств из группы углеводов, гликозидов и терпенов, полученные с помощью физических, физико-химических и химических методов.
- Объяснять особенности хранения лекарственных средств из группы углеводов, гликозидов и терпенов, исходя из их физико-химических свойств.
2. ЦЕЛЬ: Овладеть методами анализа лекарственных средств из группы углеводов и их синтетических аналогов.
3. ЦЕЛЕВЫЕ ЗАДАЧИ:
3.1. Изучить строение, номенклатуру, синонимы, физико-химические свойства, источники и методы получения лекарственных средств из группы углеводов и их синтетических аналогов.
3.2. Изучить методы анализа рассматриваемой группы лекарственных средств согласно ГФУ, АНД, МКК.
3.3. Предложить и обосновать возможные методы идентификации и количественного определения, исходя из строения лекарственных средств изучаемой группы.
|
|
|
3.4. Изучить специфические примеси, а также методы испытаний на чистоту данной группы веществ.
3.5. Рассмотреть особенности проведения анализа лекарственных средств из группы углеводов и их синтетических аналогов с использованием физических, физико-химических и химических методов.
3.6. Научиться проводить анализ качества рассматриваемой группы лекарственных средств с использованием физических, физико-химических и химических методов.
3.7. Трактовать и давать правильную оценку полученным результатам анализа, делать вывод о качестве анализируемых веществ.
3.8. Объяснять особенности хранения лекарственных средств из группы углеводов, сердечных гликозидов и их синтетических аналогов, исходя из их физико-химических свойств.
3.9. Изучить и соблюдать правила безопасной работы в химической лаборатории.
УГЛЕВОДЫ (сахара, глюциды, карбогидраты) – обширная группа природных и синтетических соединений, являющихся по химическому составу полигидроксильными веществами, содержащими альдегидную или кетонную группы, или образующие их в результате гидролиза.
Термин «углеводы» предложен в 1844 году русским химиком Карлом Шмидтом на основании элементного состава первых представителей этого класса соединений, так как было установлено, что их молекулы состоят из атомов углерода, водорода и кислорода, причем соотношение атомов водорода и кислорода такое же, как в молекуле воды [Сх(Н2О)у]. Дальнейшее изучение строения этих соединений и открытие новых веществ, не отвечающим указанной эмпирической формуле (дезоксисахара, метилпентозы, метилгексозы и др.), показало, что отнесение их к „гидратам” является лишь формальным, но принятое название „углеводы” сохранилось.
Углеводы делят на простые и сложные, в зависимости от количества моносахаридных единиц связанных в молекулу:
|
|
|
Ø простые углеводы (моносахариды, или монозы);
Ø сложные углеводы, которые в свою очередь подразделяют на:
- олигосахариды, или олигозиды;
- полисахариды (гликаны, полиозиды, полиозы, полигликозаны).
Моносахариды (гликозы, монозы, простые сахара) – группа углеводов, не способная к гидролизу. Моносахариды представляют собой полиоксиальдегиды и полиоксикетоны, которые могут существовать как в виде открытой альдегидной или кетонной формы, так и в виде циклических полуацеталей.
В настоящее время известно несколько сотен различных по структуре и стереохимии моносахаридов, которые по характеру входящей в их состав оксогруппы можно разделить на альдозы, содержащие альдегидную группу, и кетозы, содержащие кетогруппу.
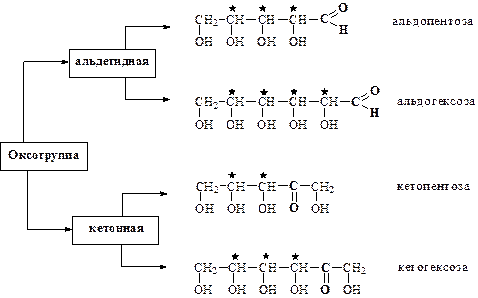
По числу углеродных атомов различают триозы, тетрозы, пентозы, гексозы и т.д. Моносахариды, в состав которых входит больше шести углеродных атомов, объединяют под общим названием «высшие сахара». Более детальная классификация моносахаридов, учитывает оба признака – число углеродных атомов и характер карбонильной группы – различает альдопентозы, альдогексозы, кетопентозы, кетогексозы и т.д.
Кроме карбонильной и гидроксильной групп в молекулу моносахарида могут входить и другие функциональные группы, например карбоксильная или аминогруппа.
Моносахариды, у которых отсутствует одна или несколько гидроксильных групп, называются дезоксисахарами. Моносахариды, содержащие вместо одной или нескольких гидроксильных групп аминогруппы, называются дезоксиаминосахарами или просто аминосахарами. Моносахариды, в которых наиболее удаленный от карбонильной группы углеродный атом входит в состав карбоксильной группы, называются уроновыми кислотами.
Конфигуруция моносахаридов. Монозы, как правило, содержат один или несколько асимметрических атомов углерода и следовательно являются оптически активными (существуют в виде различных пространственных изомеров). Например, альдопентоза имеет 3 ассиметричных атома углерода, следовательно одной и той же формуле соответствует 8 стереоизомеров (23). Альдогексоза содежит 4 ассиметричных атома углерода и может существовать в виде 16 стереоизомеров (24), т.е. N = 2n, где n – количество ассиметричных атомов углерода.
|
|
|
Для изображения их структуры на плоскости, как правило, используются проекционные формулы Э. Фишера, которые дают возможность быстро и точно изображать всю стереохимию моносахаридов. Однако для обозначения абсолютной конфигурации необходимо было принять определенную систему изображения на проекционных формулах. Она была предложена М.А. Розановым и состоит в следующем. Известны два глицериновых альдегида, являющиеся антиподами, которые могут быть изображены формулами I и II.

Согласно предложению Розанова, изомер, изображаемый формулой I, условились называть D -глицериновым альдегидом, а его антипод II – L -глицериновым альдегидом. Соответственно, все асимметрические атомы углерода, имеющие на проекционных формулах гидроксильные группы справа, а водородный атом слева от вертикальной линии обладают D -конфигурацией, а асимметрические атомы с противоположным размещением заместителей – L -конфигурацией.
Далее, все моносахариды (тетрозы, пентозы, гексозы и т.д.), у которых конфигурация атомных групп у последнего асимметрического атома углерода такая же, как и у правовращающего глицеринового альдегида, относят D -ряду, а если, как у левовращающего – к L -стереоизомерам:

Следовательно, из 16 стереоизомеров альдогексозы 8 относится к D -ряду, а 8 – к L -ряду. Представители D -ряда являются оптическими антиподами L -ряда, то есть альдогексоза существует в виде 8 пар энантиомеров. Энантиомерами называются зеркально симметричные изомеры, конфигурации у асимметрических центров которых зеркально противоположны. Соответственно, D -глюкоза и L -глюкоза являются энантиомерами:
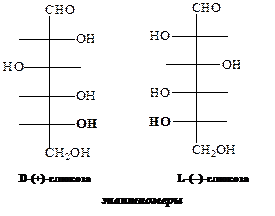
Пространственные изомеры моносахаридов, отличающиеся конфигурацией одного или нескольких атомов углерода и не являющиеся зеркальными изомерами (энантиомерами), называются диастереомерами. То есть, D -аллоза, D -альтроза, D -глюкоза, D -манноза, D -гулоза, D -идоза, D -галактоза, D -талоза – диастереомеры:



Диастереомеры, различающиеся конформацией только одного асимметрического атома углерода, называются эпимерами. Например, D -глюкоза и
D -галактоза, D -глюкоза и D -манноза. Таким образом, эпимерия является частным случаем диастереомерии.
|
|
|
Также важно отметить, что углеводы способны вращать плоскость поляризованного луча света, то есть они обладают оптической активностью. Направление вращения определяется экспериментально и никаким образом не связано с конформацией, то есть принадлежностью к D - и L -ряду. Например, D -глюкоза – правовращающая, а D -фруктоза – левовращающая. Следует помнить и о существовании рацематов. Рацемическая смесь (рацемат) – эквимолярная (состоящая из одинакового числа молекул D - и L - ряда) смесь энантиомеров, не обладающая оптической активностью.
Циклическая структура моносахаридов. Ациклические формулы, предложенные Э. Фишером, не согласуются с рядом химических свойств моноз. Прежде всего, карбонильная группа в моносахаридах не дает некоторых характерных реакций (реакций присоединения натрия сульфита, реакция с функсинсернистой кислотой), а одна из гидроксильных групп в молекуле моносахаридов проявляет особые свойства (образование моноэфиров, например метиловых). Для объяснения этих фактов была предложена полуацетальная (или иначе, лактольная) циклическая формула. То есть, моносахариды образуют циклические полуацетали в результате внутримолекулярного взаимодействия карбонильной и пространственно приближенной к ней спиртовой группы:
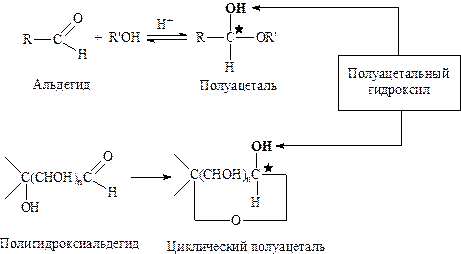
Внутримолекулярное взаимодействие приводит к тому, что атом карбонильной группы превращается в асимметрический.
Рассмотрим пример образования циклических форм D -глюкозы в результате внутримолекулярного взаимодействия оксогруппы и гидроксильной группы при С-5 углеродном атоме:
|

Таким образом, общее число изомерных моносахаридов и их производных оказывается вдвое больше, чем это предсказывает стереохимическая теория, исходя из количества асимметрических атомов углерода. Это свидетельствует о наличии в структуре моносахаридов дополнительного асимметрического центра.
После надежного доказательства циклической структуры производных моносахаридов, У. Хеуорсом были внесены дополнительные изменения в номенклатуру моносахаридов. По его предложению моносахариды, содержащие шестичленный тетрагидропирановый цикл (III), стали называть пиранозами, а пятичленный тетрагидрофурановый (IV) – фуранозами:

Ниже представлены примеры пиранозной и фуранозной форм D -глюкозы:
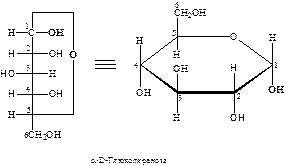
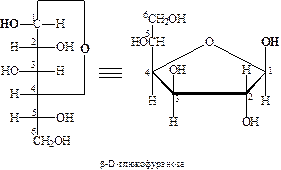
Как отмечалось выше, образование циклических форм моносахаридов приводит к появлению нового асимметрического атома. Этот хиральный центр принято называть аномерным, соответствующие ему два новых стереоизомера – α- и β-аномерами. Аномеры – диастереомеры, отличающиеся конфигурацией аномерного атома углерода. В настоящее время по предложению Фрейденберга α-аномером (изомером) называют аномер, имеющий одинаковую конфигурацию у С1 и у последнего асимметрического атома, определяющего принадлежность к D - или L -ряду, а β-аномером – аномер, имеющий противоположные конфигурации при этих атомах:

Следует также отметить, что образовавшаяся в процессе циклизации гидроксильная группа при аномерном центре является полуацетальной (гликозидной).
Таутомерия моносахаридов. Химические свойства сахаров не могут быть полностью объяснены, если для них применить строение полиоксикарбонильных соединений. Однако и циклические полуацетальные формулы, устраняющие ряд противоречий, неудовлетворительны, поскольку они не объясняют ряд свойств карбонильной группы моносахаридов, то есть образовывать ациклические производные (например, присоединять синильную кислоту с образованием оксинитрилов, давать тиоацетали и т.д.). Это привело к заключению, что моносахариды способны к таутомерным превращениям.
Данное утверждение было подтверждено экспериментально путем исследования их оптической активности, а также с помощью спектральных методов (ИК- и ЯМР-спектроскопии).
Установлено, что моносахариды в водном растворе способны существовать в виде нескольких таутомерных форм – открытых (линейных) и циклических. Такой вид таутомерии был назван кольчато-цепной, или цикло-оксо-таутомерией – состояние динамического равновесия между циклической и открытой формами моносахаридов в растворе.
Переход одной формы в другие происходит непрерывно. Через определенное время в растворе устанавливается подвижное (динамическое) равновесие, при котором количество всех форм остается постоянным. Например, равновесная система для D -глюкозы в водном растворе состоит из β -D -глюкопиранозы (≈ 64%) и α- D -глюкопиранозы (≈ 36%). Вклад фуранозных форм (вместе ≈ 1%) и открытой (линейной) формы (≈ 0,024%) незначителен.
Схема цикло-оксо-таутомерии D -глюкозы:
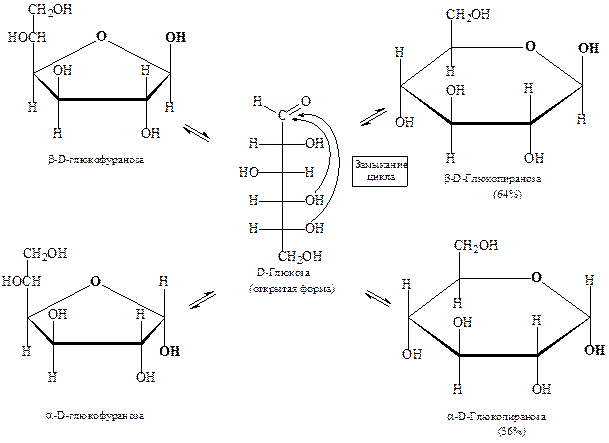
Мутаротация – самопроизвольное изменение величины оптического вращения свежеприготовленных растворов оптически активных соединений. Данное явление характерно для моносахаридов и восстанавливающих олигосахаридов. В основе данного явления лежат приведенные выше таутомерные превращения.
Олигосахариды (олигозиды, голозиды) – полимерные углеводы, построенные из небольшого числа (2-10) остатков моносахаридов и не содержащие никаких компонентов неуглеводного характера. Соответственно, при гидролизе образуют от 2 до 10 молекул моносахаридов.
Наибольшее значение из данной группы веществ имеют дисахариды – углеводы, молекулы которых состоят из двух остатков моносахаридов одинаковой или разной природы, соединенных между собой гликозидной связью.
В зависимости от способа образования гликозидной связи олигосахара традиционно разделяют на две группы – восстанавливающие и невосстанавливающие.
К первой группе относятся сахара, в которых полуацетальный гидроксил одной монозы конденсирован со спиртовым гидроксилом другой. Таким образом, у образовавшегося димера (тримера и т.д.) за счет полуацетального гидроксила сохраняются восстановительные свойства. Например, лактоза является восстанавливающим дисахаридом:
|
|



|
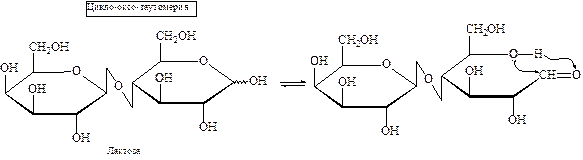
Если же в образовании олигомера задействованы полуацетальные гидроксильные группы всех входящих в состав моноз, то продукт конденсации будет лишен восстановительных свойств и будет отнесен к невосстанавливающим олигосахарам. Например, сахароза является невосстанавливающим дисахаридом:
|

Под действием минеральных кислот при нагревании, а также в процессе ферментации сахароза гидролизуется с образованием смеси D -глюкозы и D -фруктозы. При этом происходит изменение величины и знака удельного вращения раствора, то есть характерное для сахарозы вращение плоскости поляризации вправо (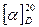 = +66,5°) изменяется на левоевращение (
= +66,5°) изменяется на левоевращение (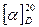 ≈ –40°]. Это явление получил название «инверсии», а образующаяся в процессе гидролиза смесь равных количеств D-глюкозы и D-фруктозы называется инвертным
≈ –40°]. Это явление получил название «инверсии», а образующаяся в процессе гидролиза смесь равных количеств D-глюкозы и D-фруктозы называется инвертным
сахаром. Причиной инверсии сахарозы является относительно большее оптическое вращение D -фруктозы влево (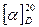 = –93°), чем D -глюкозы вправо (
= –93°), чем D -глюкозы вправо (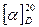 = +52,5°), поэтому образующаяся при гидролизе смесь суммарно обладает левым вращением.
= +52,5°), поэтому образующаяся при гидролизе смесь суммарно обладает левым вращением.
Полисахариды (гликаны, полиозиды, полиголозиды, полиозы, полигликозы, полигликозаны) – высокополимерные углеводы, построенные из большого числа остатков моносахаридов и не содержащие никаких компонентов неуглеводного характера. К полисахаридам принято относить углеводы, гидролизующиеся с образованием более 10 молекул моносахаридов.
В зависимости от моносахаридного состава полисахариды подразделяются на два обширных класса – гомо- и гетерополисахариды.
Гомополисахариды – полимеры, состоящие из остатков только одного моносахарида, например, из глюкозы (глюканы: крахмал, целлюлоза, гликоген, декстран, ламинаран) и др.
Гомополисахарид крахмал состоит из двух фракций:
1) линейная, растворимая в воде – амилоза:

2) разветвленная, нерастворимая в воде – амилопектин:

Гетерополисахариды – сополимеры, в состав которых входят различные моносахариды, например, глюкоза и манноза (глюкоманнаны, эремуран), галактоза и манноза (галактоманнаны) или несколько моносахаридов (камеди растений).
Гетерополисахаридами являются хондроитинсульфаты – одни из главных компонентов хрящевой ткани. Повторяющимся звеном хондроитинсульфатов является D -глюкуроновая кислота и N -ацетил- D -галактозамин, содержащий сульфогруппу. Наиболее важное значение имеют хондроитинсульфаты, в которых остаток серной кислоты образует эфирную связь с гидроксильной группой N -ацетил- D -галактозамина либо в положении 4 (хондроитин-4-сульфат), либо в положении 6 (хондроитин-6-сульфат):

Препараты хондроитин сульфата стимулируют процессы регенерации и замедляют дегенерацию хрящевой ткани, нормализуют продукцию суставной жидкости.
4. ПЛАН И ОРГАНИЗАЦИОННАЯ СТРУКТУРА ЗАНЯТИЙ:
4.1. Организационные вопросы – 3 минуты.
4.2. Постановка цели занятия и мотивация изучения темы занятия (вступительное слово преподавателя) – 7 минут.
4.3. Инструктаж по безопасным условиям проведения лабораторной работы – 5 минут.
4.4. Контроль и коррекция исходного уровня знаний-умений – 35 минут.
4.5. Организация самостоятельной работы студентов (целевые указания преподавателя, техника безопасности) – 5 минут.
4.6. Лабораторная работа и оформление протоколов – 110 минут.
4.7. Итоговый контроль: проверка результатов лабораторной работы и протоколов – 10 минут.
4.8. Заключительное слово преподавателя, указания к следующему занятию – 5 минут.
5. ЗАДАНИЕ ДЛЯ САМОПОДГОТОВКИ СТУДЕНТОВ:
5.1. Повторить теоретический материал из курсов органической и аналитической химии по данной теме.
5.2. Изучить программный материал по теме занятия согласно вопросам, приведенным ниже.
Учебные вопросы для самоподготовки студентов
1. Углеводы. Общая характеристика, классификация. Распространение в природе. Роль углеводов в жизнедеятельности человека. Понятие о дезокси- и аминосахарах.
2. Источники получения, химическое строение, номенклатура, синонимы лекарственных веществ из группы углеводов.
3. Охарактеризовать физико-химические свойства лекарственных веществ из группы углеводов. Константы оптической активности как показатели качества лекарственных средств из группы углеводов.
4. Обосновать использование химических и инструментальных методов в анализе качества лекарственных средств из группы углеводов.
5. Моносахариды. Классификация. Стереоизомерия и таутомерия моносахаридов. Лекарственные средства из группы моносахаридов, источники и методы получения.
5.1. Глюкоза безводная. Глюкоза моногидрат. Строение, номенклатура, свойства, применение.
5.2. На примере глюкозы объясните явление мутаротации. Что является химической основой данного явления?
5.3. Приведите возможные методы и реакции идентификации препаратов глюкозы.
5.4. Испытания на чистоту препаратов глюкозы. Пути попадания и определение специфических примесей (посторонние сахара, растворимый крахмал, декстрины).
5.5. Охарактеризуйте возможные методы количественного определения препаратов глюкозы. Приведите соответствующие уравнения реакций, расчетные формулы.
5.6. Фруктоза. Строение, номенклатура, свойства, анализ, применение. Пути попадания и определение специфических примесей во фруктозе (посторонние сахара, 5-гидроксиметилфурфурол и родственные соединения).
5.7. Галактоза. Строение, номенклатура, свойства, анализ, применение.
6. Олигосахариды. Классификация. Восстанавливающие и невосстанавливающие дисахариды. Лекарственные средства из группы олигосахаридов, источники и методы получения.
6.1. Сахароза. Строение, номенклатура, свойства, применение.
6.2. Явление инверсии на примере сахарозы. Определение примеси инвертного сахара в сахарозе.
6.3. Идентификация и методы количественного определения сахарозы. Приведите соответствующие уравнения реакций, расчетные формулы.
6.4. Лактоза безводная. Лактоза моногидрат. Строение, номенклатура, свойства, применение.
6.5. Идентификация и методы количественного определения препаратов лактозы. Приведите соответствующие уравнения реакций, расчетные формулы.
7. Полисахариды. Классификация. Гомо- и гетерополисахариды. Лекарственные средства из группы полисахаридов, источники и методы получения.
7.1. Крахмал. Строение, свойства, анализ, применение.
7.2. Целлюлоза. Метилцеллюлоза. Строение, свойства, анализ, применение.
7.3. Декстраны. Декстран 40 для инъекций. Полиглюкин. Реополиглюкин. Строение, свойства, анализ, применение.
7.4. Инулин. Строение, свойства, применение.
7.5. Гиалуроновая кислота. Хондроитинсульфат. Строение, свойства, анализ, применение.
7.6. Гепарин. Гепарин кальция. Гепарин натрия. Гепарины низкомолекулярные. Эноксапарин натрия. Строение, свойства, анализ, применение.
8. Особенности хранения лекарственных средств из группы углеводов.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 4584; Нарушение авторских прав?; Мы поможем в написании вашей работы!