
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Получение. Азот в промышленности получают ректификацией воздуха, в лаборатории – окислением аммиака (1), реакциями внутримолекулярного окисления-восстановлен
|
|
|
|
Подругппа кислорода
Химические свойства.
Химические свойства.
Химические свойства.
Получение.
Азот в промышленности получают ректификацией воздуха, в лаборатории – окислением аммиака (1), реакциями внутримолекулярного окисления-восстановления соединений азота (2), восстановлением азотной кислоты (3):
1. 2NH3 + 3CuO → N2 + 3Cu + 3H2O;
2. NH4NO2 → N2 + H2O;
3. 5Mg + 12HNO3(p) → N2 + 5Mg(NO3)2 + 6H2O.
1. При высоких температурах азот реагирует с активными металлами:
3Mg + N2 → Mg3N2
2. В электрическом разряде азот реагирует с кислородом:
N2 + O2 → 2NO
3. С водородом азот реагирует при нагревании, под высоким давлением и в присутствии катализатора:
N2 + 3H2 ↔ 2NH3
АммиакNH3. При обычных условиях газ с резким запахом, хорошо растворимый в воде.
Получение. В лаборатории аммиак получают действием щелочей на растворы солей аммония при нагревании:
NH4Cl + KOH → NH3↑ + KCl + H2O
В промышленности аммиак получают по обратимой реакции с катализатором Fe/Al2O3, температурах 450-500 оС, под давлением 1000 атм:
N2 + 3H2 ↔ 2NH3 + Q
1. Аммиак реагирует с водой:
NH3 + H2O ↔ NH4OH
2. С кислотами:
NH3 + HCl → NH4Cl
3. С окислителями:
2NH3 + 3CuO → N2↑ + 3Cu + 3H2O
4. В присутствии катализатора с кислородом:
4NH3 + 5O2 → 4NO + 6H2O
5. С кислородом без катализатора:
4NH3 + 3O2 → 2N2↑ + 6H2O
Соли аммония. Они состоят из катиона аммония (NH4+) и аниона кислоты. Хорошо растворимы в воде.
1. Проявляют свойства солей:
NH4Cl + AgNO3 → AgCl ↓+NH4 NO3
2. Гидролиз:
NH4Cl + H2O ↔ NH3•H2O + HCl
3. Разлагаются при нагревании:
NH4Cl → NH3 + HCl
Главную подгруппу шестой группы составляют кислород, сера, селен, теллур и полоний. Все эти элементы имеют электронные конфигурации внешнего валентного слоя типа (соответственно у кислорода, серы, селена и теллура), что обусловливает прежде всего окислительные свойства этих элементов, хотя при переходе от кислорода к теллуру и полонию окислительная способность элементов резко ослабляется.
|
|
|
Наибольшей окислительной способностью обладают кислород и сера, которые в виде простых веществ являются типичными неметаллами. Селен и теллур занимают промежуточное положение между неметаллами и металлами, а полоний проявляет типично металлические свойства.
Для всех элементов подгруппы кислорода характерно проявление в соединениях степени окисления, равной 2-. Все элементы этой подгруппы, за исключением кислорода, способны также давать соединения, где степень их окисления равна или это связано с существованием свободной -орбитали на внешней оболочке.
Кислород во всех своих соединениях (кроме соединений с фтором, где степень его окисления и пероксидных соединений со степенью окисления 1-), имеет степень окисления 2-.
В промышленности кислород получают: 1) фракционной перегонкой жидкого воздуха (азот, обладающий более низкой температурой кипения, испаряется, а жидкий кислород остается); 2) электролизом воды.
В лабораторных условиях кислород получают разложением ряда солей, оксидов и пероксидов:
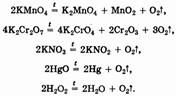
В частности, пероксиды щелочных металлов используют на космических станциях для обеспечения космонавтов кислородом за счет его регенерации из выдыхаемого
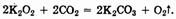
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1034; Нарушение авторских прав?; Мы поможем в написании вашей работы!