
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. · Относится к группе кислотных оксидов
|
|
|
|
Свойства
· Относится к группе кислотных оксидов.
· При нагревании взаимодействует с основными оксидами и щелочами.
· Реагирует с плавиковой кислотой.
· SiO2 относится к группе стеклообразующих оксидов, то есть склонен к образованию переохлажденного расплава — стекла.
· Один из лучших диэлектриков (электрический ток не проводит, если не имеет примесей и не нагревается).
Диоксид кремния SiO2 — кислотный оксид, не реагирующий с водой.
Химически стоек к действию кислот, но реагирует с газообразным фтороводородом:

и плавиковой кислотой:

Эти две реакции широко используют для травления стекла.
При сплавлении SiO2 с щелочами и основными оксидами, а также с карбонатами активных металлов образуются силикаты — соли не имеющих постоянного состава очень слабых, нерастворимых в воде кремниевых кислот общей формулы xH2O·ySiO2 (довольно часто в литературе упоминаются не кремниевые кислоты, а кремниевая кислота, хотя фактически речь при этом идет об одном и том же веществе).
Например, может быть получен ортосиликат натрия:

метасиликат кальция:

или смешанный силикат кальция и натрия:

Из силиката Na2CaSi6O14 (Na2O·CaO·6SiO2) изготовляют оконное стекло.
Большинство силикатов не имеет постоянного состава. Из всех силикатов растворимы в воде только силикаты натрия и калия. Растворы этих силикатов в воде называют жидким стеклом. Из-за гидролизаэти растворы характеризуются сильно щелочной средой. Для гидролизованных силикатов характерно образование не истинных, а коллоидных растворов. При подкислении растворов силикатов натрия или калия выпадает студенистый белый осадок гидратированных кремниевых кислот.
Главным структурным элементом как твердого диоксида кремния, так и всех силикатов, выступает группа [SiO4/2], в которой атом кремния Si окружен тетраэдром из четырёх атомов кислорода О. При этом каждый атом кислорода соединен с двумя атомами кремния. Фрагменты [SiO4/2] могут быть связаны между собой по-разному. Среди силикатов по характеру связи в них фрагментов [SiO4/2] выделяют островные, цепочечные, ленточные, слоистые, каркасные и другие.
|
|
|
Кремниевые кислоты — очень слабые, малорастворимые в воде кислоты общей формулы nSiO2•mH2O
Номенклатура[править | править вики-текст]
Из кремниевых кислот известны: метакремниевая H2SiO3, ортокремниевая H4SiO4, дикремниевые H2Si2O5 и H10Si2O9, пирокремниевая H6Si2O7 и поликремниевые nSiO2•mH2O. Соответствующие соли называют силикатами (метасиликаты, ортосиликаты и др.).
Физические и химические свойства
Все поликремниевые кислоты малорастворимы в воде. В воде образуют коллоидные растворы по общей схеме реакции:
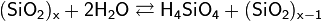
Образовавшаяся неустойчивая ортокремниевая кислота вступает в реакции поликонденсации:

в результате чего образуются сложные линейные, разветвлённые и смешанные структуры.
Изоэлектрическая точка поликремниевых кислот находится в интервале pH 2,0-3,0, в котором поликонденсация идёт с минимальной скоростью.
Кремниевые кислоты являются слабыми. Для метакремниевой кислоты H2SiO3 константы диссоциации K1 = (2-3)•10-10, K2 ~ 10-11÷-13, для ортокремниевой H4SiO4 K1 = 2•10-10, K2 = K3 = K4 = 2•10-12.
Кремниевые кислоты растворяются в растворах и расплавах щелочей, образуя силикаты:

Ортокремниевая кислота способна образовывать ортосиликаты-эфиры в общем случае имеющие вид R1R2R3R4SiO4, где R1-4 - органические радикалы, как правило, являющиеся спиртовыми остатками. Известным массовым продуктом является тетраэтилортосиликат состава Si(C2H5O)4
Получение
Растворы кремниевых кислот получают растворением аморфного диоксида кремния в воде, действием сильных кислот на растворимые силикаты натрия или калия:
|
|
|

гидролизом хлорсиланов:

а также методами электродиализа и ионного обмена.
Соли кремниевой кислоты
Общая формула кремниевых кислот – n SiO2? m H2O. В природе находятся в основном в виде солей, в свободной форме выделены немногие, например, HSiO (ортокремниевая) и H2SiO3 (кремниевая или метакремниевая).
Получение кремниевой кислоты:
1) взаимодействие силикатов щелочных металлов с кислотами: Na2SiO3 + 2HCl = H2SiO3 + 2NaCl;
2) кремневая кислота является термически неустойчивой: H2SiO3 = H2O + SiO2.
H2SiO3 образует пересыщенные растворы, в которых в результате полимеризации образует коллоиды. Используя стабилизаторы, можно получить стойкие коллоиды (золи). Их используют в производстве. Без стабилизаторов из раствора кремниевой кислоты образуется гель, осушив который можно получить силикагель (используют как адсорбент).
Силикаты – соли кремниевой кислоты. Силикаты распространены в природе, земная кора состоит в большинстве из кремнезема и силикатов (полевые шпаты, слюда, глина, тальк и др.). Гранит, базальт и другие горные породы имеют в своем составе силикаты. Изумруд, топаз, аквамарин – кристаллы силикатов. Растворимы только силикаты натрия и калия, остальные – нерастворимы. Силикаты имеют сложный химический состав:
Каолин Al2O3; 2SiO2; 2H2O или H4Al2SiO9.
Асбест CaO; 3MgO; 4SiO2 или CaMgSi4O12.
Получение: сплавление оксида кремния со щелочами или карбонатами:

Растворимое стекло – силикаты натрия и калия. Жидкое стекло – водные растворы силикатов калия и натрия. Его используют для изготовления кислотоупорного цемента и бетона, керосинонепроницаемых штукатурок, огнезащитных красок. Алюмосиликаты – силикаты, содержащие алюминий (полевой шпат, слюда). Полевые шпаты состоят помимо оксидов кремния и алюминия из оксидов калия, натрия, кальция – K2O?Al2O3?6SiO2 – ортоклаз.
Слюды имеют в своем составе, кроме кремния и алюминия, еще водород, натрий или калий, реже – кальций, магний, железо.
Граниты и гнейсы (горные породы) – состоят из кварца, полевого шпата и слюды. Горные породы и минералы, находясь на поверхности Земли, вступают во взаимодействие с водой и воздухом, что вызывает их изменение и разрушение. Этот процесс называется выветриванием.
|
|
|
Выветривание ортоклаза:

Применение: силикатные породы (гранит) используют как строительный материал, силикаты – в качестве сырья при производстве цемента, стекла, керамики, наполнителей; слюду и асбест – как электро– и термоизоляцию.
Силикаге́ль представляет собой высушенный гель, образующийся из перенасыщенных растворов кремниевых кислот (n SiO2· m H2O) при pH > 5—6. Твёрдыйгидрофильный сорбент.
Получение
Получается при подкислении растворов силикатов щелочных металлов с последующей промывкой и высушиванием образовавшегося геля:


Свойства
Силикагель имеет огромную площадь поверхности (800 м²/1 г), состоящую из групп —SiOH, расположенных на расстоянии 0,5 нм друг от друга. Эти группы являются активными центрами, причём активность конкретной партии силикагеля зависит от числа и активности таких центров. В активном адсорбенте, то есть таком, из которого удалена адсорбированная на его поверхности вода, многие центры будут активны. Такая активация происходит при нагревании геля до 150—200 °C.
При нагревании до более высокой температуры в интервале 200—400 °C активность теряется в результате образования связей Si-O, происходящего с отщеплением воды. Эта стадия, однако, обратима. При нагревании выше 400 °C размер поверхности силикагеля необратимо уменьшается.
Активные центры взаимодействуют с полярными растворёнными веществами главным образом за счёт образования водородных связей.
Способ получения
· Силикагель получают взаимодействием силиката натрия с кислотой, щелочного силиката с солью аммония из концентрированных золей коллоидного кремнезема
· Разбавлением растворов при низких значениях pH и температурах ниже комнатной.
· Гидролизом соединений кремния (хлорид кремния, ортокремниевые эфиры).
Стекло́ — вещество и материал, один из самых древних и, благодаря разнообразию своих свойств, — универсальный в практике человека. Структурно — аморфно,изотропно; все виды стёкол при формировании преобразуются в агрегатном состоянии — от чрезвычайной вязкости жидкого до так называемого стеклообразного — в процессе остывания со скоростью, достаточной для предотвращения кристаллизации расплавов, получаемых плавлением сырья (шихты) [1][2]. Температура варки стёкол, от +300 до +2500 °C, определяется компонентами этих стеклообразующих расплавов (оксидами, фторидами, фосфатами и других)[2]. Прозрачность (для видимого человеком излучения) не является общим свойством для всех видов, существующих как в природе, так и в практике стёкол.
|
|
|
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1382; Нарушение авторских прав?; Мы поможем в написании вашей работы!