
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. 1. В промышленности аммиак получают прямым синтезом из азота и водорода: Для протекания реакции наиболее оптимальными условиями являются наличие катализатора
|
|
|
|
Физические свойства
Получение
1. В промышленности аммиак получают прямым синтезом из азота и водорода:
Для протекания реакции наиболее оптимальными условиями являются наличие катализатора, температуры 500°С и давления 2,9•104 кПа.
Реакция экзотермична, поэтому согласно принципу Ле Шателье равновесие будет смещено вправо тем больше, чем ниже температура. Однако при низких температурах теряет активность катализатор и скорость реакции очень мала. В качестве катализатора используется пористое железо, содержащее в виде добавок оксиды алюминия, калия, кальция, кремния. Реакцию ведут при температуре около 500°С, компенсируя вызываемый сдвиг равновесия влево повышением давления.
Промышленные установки синтеза аммиака работают с использованием принципа циркуляции: после реакции смесь газов охлаждается, содержащийся в ней аммиак конденсируется и отделяется, а непрореагировавшие азот и водород смешиваются со свежей порцией газов, снова подаются в колонну синтеза и т.д. Удаление аммиака из равновесной смеси сдвигает равновесие реакции вправо.
2. В лабораторных условиях аммиак получают нагреванием солей аммония с щелочами:
2NH4Cl+Са(ОН)2=СаСl2+2NH3+2Н2O
Эта реакция основана на смещении равновесия взаимодействия аммиака с водой при добавлении гидроксид-ионов:
+Н2ОNH+4+ОН-=NH3
Аммиак — бесцветный ядовитый газ с характерным удушливым запахом. Почти в два раза легче воздуха. При увеличении давления или при охлаждении он легко сжижается в бесцветную жидкость (tкип=-33,4°С). Очень хорошо растворим в воде (в 1 л воды при 0°С растворяется до 1000 л NH3). Раствор аммиака, [содержащий 25% NH3, называется нашатырным спиртом.
1. Так как степень окисления азота в аммиаке -3, то он является восстановителем и может легко окисляться до N2 или N+2.
а) галогены обычно окисляют аммиак до свободного азота:
|
|
|
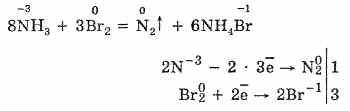
б) в смеси с кислородом аммиак горит зеленовато-желтым пламенем:
4N-3H3+3O02=6Н2О-2+N02
в) если взаимодействие с кислородом протекает при высокой температуре в присутствии катализатора, то окисление NH3 сопровождается образованием оксида азота (II):
4N-3H3+5O02=6Н2O-2+4N+2O
Эта реакция имеет практическое значение, т.к. используется для получения азотной кислоты.
г) аммиак энергично восстанавливает некоторые металлы из их оксидов:
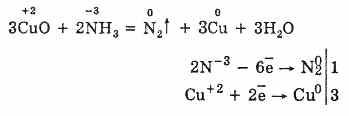
2. В молекуле аммиака неподеленная электронная пара азота создает условия для присоединения к молекуле протона по донорно-акцепторному механизму, превращая ее в однозарядный катион NH+4:
[NH4]+®:NH3 +H+
В образовавшемся катионе положительный заряд распределен равномерно. По этому механизму аммиак реагирует с водой.
[NH4]++ОН-«:NH3+Н2О
В образовавшемся катионе аммония четыре ковалентные связи, из них одна образована по донорно-акцепторному механизму.
Гидроксид-ионы обуславливают слабощелочную (их мало) реакцию аммиачной воды. При взаимодействии гидроксид-ионов с ионами NH+4 снова образуются молекулы NH3 и Н2О, соединенные водородной связью, т.е. реакция протекает в обратном направлении:
NH+4+ОН-«NH3•Н2O«NH3+Н2О
В аммиачной воде большая часть аммиака содержится в виде молекул NH3, равновесие смещено в сторону образования аммиака, поэтому она пахнет аммиаком. Тем не менее водный раствор аммиака обозначают NH4OH и называют гидроксидом аммония, а щелочную реакцию объясняют как результат диссоциации:
NH+4+OH-NH4OH относят к слабым основаниям.«NH4OH
Газообразный аммиак взаимодействует и с кислотами, образуя соли аммония: NH3+HCl=NH4Cl
Эта реакция протекает и в газовой среде. При этом к молекуле аммиака присоединяется ион водорода кислоты, образуя ион аммония, входящий в состав соли.
3. Соли аммония аналогичны соответствующим солям однозарядных ионов металлов. Получают при взаимодействии аммиака или его водных растворов с кислотами:
NH3+HNO3=NH4NO3
NH4OH+HNO3=NH4NO3+H2O
или в ионной форме: NH3+Н+=NH+4 NH4OH+Н+=NH+4+Н2O
а) Они проявляют общие свойства солей, т.е. взаимодействуют с растворами щелочей, кислот и других солей:
NH4Cl+NaOH=NaCl+Н2O+NH3
2NH4Cl(к)+H2SO4=(NH4)2SO4+2HCl
+2NH4Cl¯(NH4)2SO4+BaCl2=BaSO4
б) Все аммонийные соли термически неустойчивы:
— если соль образована летучей кислотой, то при нагревании идет полное разложение, однако при охлаждении выделяющиеся газы вновь взаимодействуют с образованием исходного вещества:
t холодNH3(r)+НСl(р)«NH4Cl(тв)
— если образована нелетучей кислотой, то происходит частичное разложение:
+NH4HSO4(NH4)2SO4=NH3
— соли аммония, в которых анион проявляет выраженные окислительные свойства, при нагревании подвергаются окислительно-восстановительным изменениям, вследствие чего разложение протекает необратимо:
|
|
|
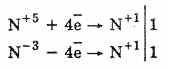
+2Н2ОN-3H4N+5O3 = N+12O
+2Н2ОNH4NO2=N2
в) Аммонийные соли хорошо растворимы в воде. Подвергаются гидролизу. Растворы солей аммония имеют кислую реакцию:
NH3+H3O+«NH4++H2O
г) Качественной реакцией на ион аммония является взаимодействие солей аммония с растворами щелочей при нагревании. При этом появляется запах аммиака и синее окрашивание влажной красной лакмусовой бумажки:
+H2ONH3«NH4++OH-
4. За счет содержания ионов водорода аммиак может быть окислителем.
При взаимодействии жидкого аммиака с металлическим натрием восстанавливается водород и окисляется металл. Образуется амид натрия.
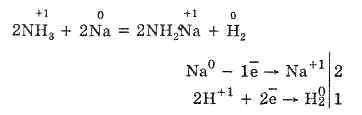
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 754; Нарушение авторских прав?; Мы поможем в написании вашей работы!