
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изменения мРНК при талассемии демонстрируют механизм возникновения новых белков при сплайсинге 2 страница
|
|
|
|
9.3.11. Факторы, связанные с хроматином, обеспечивают однократную репликацию ДНК в каждой S-фазе, блокируя повторение этого процесса [40]
У нормальной клетки в S-фазе весь геном должен реплицироваться только один раз. Как было показано выше, репликация ДНК в большинстве эукариотических клеток протекает асинхронно в течение определенного промежутка времени. В связи с тем, что точки начала репликации в разных участках хромосомы активируются в разное время, к середине S-фазы некоторые части хромосом еще не начинают реплицироваться, тогда как другие уже реплицированы полностью. Таким образом, в середине и в поздней S-фазе возникает сложная «бухгалтерская» задача. К этому времени некоторые точки начала репликации уже удвоились, тогда как другие (вероятно, с аналогичной последовательностью ДНК) ещё не были задействованы. Однако известно, что каждая точка начала репликации в каждой S-фазе может использоваться только один раз. Как же это достигается?
Ключ к решению данной проблемы дали опыты по слиянию клеток. Если клетки, находящиеся в S-фазе, слить с клетками, находящимися в Gl-фазе, то в Gl-ядре индуцируется синтез ДНК. Можно предположить, что переход из фазы G1 в S-фазу обусловлен действием диффундирующего активатора синтеза ДНК. Иная картина имела место, когда с клетками, находящимися в S-фазе, сливали клетки на стадии G2
(т.е. только что закончившие S-фазу). В этом случае в G2-ядре синтез ДНК не начинался, а в ядре, находящемся в S-фазе, он по-прежнему шел.
Таким образом, ядро, находящееся на стадии G2 (его ДНК уже реплици-ровалась), ведет себя так, как будто оно защищено от вхождения в последующие циклы репликации неким недиффундирующим ингибитором, тесно связанным с ДНК. Подобный ингибитор, если бы он действительно существовал, мог бы помочь каждой репликационной
|
|
|
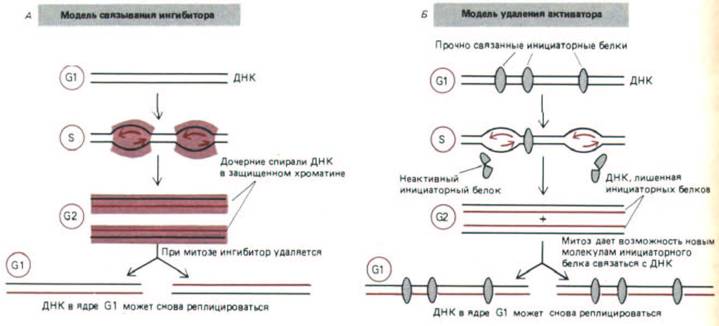
Рис. 9-63. Два возможных механизма блокировки повторной репликации ДНК, которая препятствует удвоению в данном клеточном цикле уже реплицированной ДНК. Отсутствие такой блокировки в некоторых типах клеток (например, в клетках слюнных желез дрозофилы)
приводит к образованию гигантских политенных хромосом А. Модель, согласно которой с вновь синтезировавшимся хроматином соединяется ингибитор. Б. Модель, предполагающая существование инициаторных белков, действующих однократно и связывающихся с ДНК лишь во время митоза.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
вилке решить «бухгалтерскую» задачу: модифицируя хроматин вновь синтезированной ДНК, он предотвращал бы повторную репликацию уже реплицировавшейся ДНК в одной и той же S-фазе (рис. 9-63, А). В качестве альтернативы можно также предположить существование иного механизма, основанного на том, что с ДНК тесно связаны инициаторные белки, которые после прохождения репликационной вилки инактивируются (рис. 9-63, Б). Чем бы ни объяснялась блокировка повторной репликации ДНК, она должна исчезнуть к началу митоза или во время его, так как после деления клетки ДНК, попадающая в дочернюю клетку, ядро которой находится на стадии G1, уже не защищена. Оказалось, что механизм блокировки повторной репликации действует и на фрагменты бактериальной ДНК, инъецированные в оплодотворенную яйцеклетку лягушки. Следовательно, механизм, ответственный за блокировку, не требует присутствия высокоспецифической точки начала репликации.
Блокировка не действует на вирус SV40, вероятно, потому, что его Т-антиген обладает как инициаторной, так и геликазной активностью и замещает собой аналогичные компоненты хозяйских клеток, функция которых еще не ясна (см. разд. 9.3.3.)
|
|
|
Заключение
Использование различных модельных систем при изучении репликации ДНК показало, что у эукариот, как и у прокариот, этот процесс
начинается с посадки геликазы на ДНК с помощью инициаторного белка, связывающегося с точкой начала репликации. По мере удаления двуx
репликационных вилок друг от друга образуется репликационный глазок. У высших эукариот в течение S-фазы соседние точки начала репликации, по-видимому, активируются группами (их называют репликационными единицами). Так как репликационная вилка движется со скоростью около
50 нуклеотидов в секунду, для завершения репликации ДНК в пределах одной единицы требуется приблизительно час. В ходе S-фазы, длящейся 8 ч, по очереди активируются различные кластеры сайтов начала репликации. Порядок активации определяется отчасти структурой их хроматина, наиболее конденсированные области хромосом реплицируются последними. Взаимосвязь между единицами репликации и сегментами на
митотических хромосомах эукариот позволяет предположить, что единицы репликации могут соответствовать структурно различающимся
доменам интерфазного хроматина.
После прохождения репликационной вилки структура хроматина переформируется путем добавления новых гистонов и других
хромосомных белков к старым гистонам, унаследованным дочерней молекулой ДНК. Для предотвращения второго цикла репликации, следующего
непосредственно за первым (т.е. до того, как хромосома вступит в митоз), в клетке предусмотрена блокировка. Она необходима для того, чтобы
в каждой S-фазе любая область ДНК реплицировалась только один раз.
9.4. Синтез и процессинг РНК [41]
До сих пор мы говорили о хромосоме, как об очень крупном комплексе ДНК и белка, который перед делением клетки реплицируется.
Однако главное предназначение хромосомы - служить матрицей для синтеза молекул РНК, поскольку только в таком виде генетическая информация, заключенная в хромосомах, непосредственно используется клеткой. РНК синтезируется весьма интенсивно: общая скорость включения нуклеотидов в РНК во время интерфазы примерно в 20 раз превышает скорость включения нуклеотидов в ДНК в S-фазе.
|
|
|
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
Синтез РНК (транскрипция ДНК) обладает высокой специфичностью. Например, в большинстве клеток млекопитающих функциональные последовательности РНК копируются приблизительно с 1% последовательностей ДНК (зрелая матричная РНК или структурная РНК). Отбор происходит на двух уровнях, которые будут по очереди обсуждаться в этом разделе: 1) для образования ядерных РНК транскрибируется лишь часть последовательности ДНК и 2) только меньшая часть нуклеотидных последовательностей ядерной РНК остается после процес -синга, который предшествует экспорту молекул РНК в цитоплазму. Начнем с описания РНК-полимеразы - фермента, катализирующего всю транскрипцию ДНК.
9.4.1. РНК-полимераза, начиная каждую новую цепь РНК, меняет субъединицы [42]
Общее описание транскрипции ДНК дано в гл. 5. Транскрипция начинается, когда молекула РНК-полимеразы связывается с последовательностью промотора в ДНК. В ходе инициации две цепи ДНК локально расходятся, образуя открытый комплекс, в котором матричная цепь оказывается экспонированной. После образования этого комплекса по-лимераза начинает движение вдоль ДНК, удлиняя растущую цепь РНК в направлении от 5' к 3' путем последовательного добавления рибонуклеозидтрифосфатов. Так происходит до тех пор, пока не будет достигнут сигнал остановки (терминации), где вновь синтезированная цепь РНК и полимераза отсоединяются от ДНК, Таким образом, каждая молекула РНК -
это одноцепочечная копия нуклеотидной последовательности ДНК, представляющей относительно короткий участок генома (см. рис. 5-1).
РНК-полимеразы обычно состоят из нескольких полипептидных цепей и имеют мол. массу 500000 дальтон и более. У бактерий и эукариот эти ферменты эволюционно близки (рис. 9-64). В связи с тем, что бактериальный фермент изучать гораздо легче, его свойства послужили основой для понимания того, как функционирует аналогичный фермент эукариот. РНК-полимераза E.coli содержит пять субъединиц: α, β,,β`, σ и ω, (по две копии α и по одной каждой из субъединиц). По нуклеотидной последовательности гена реконструирована полная аминокислотная последовательность каждой субъединицы, а данные футпринтинга ДНК свидетельствуют о том, что при соединении с ДНК фермент закрывает 60
|
|
|
нуклеотидных пар.
Сигма (.)-субъединица РНК-полимеразы E.coli имеет специфическую функцию и служит фактором инициации транскрипции. Эта субъединица дает возможность ферменту найти консенсусные последовательности промотора. РНК-полимеразы, узнающие разные промоторы, содержат различные формы. -субъединицы. Связавшись с промотором, фермент, для того чтобы начать синтез РНК, вступает в ряд реакций (рис.
9-65). После того, как синтезировано примерно восемь нуклеотидов молекулы РНК (стадия 4, рис. 9-65),. -субъединица диссоциирует, а вместо нее с молекулой фермента соединяется несколько факторов элонгации, необходимых для удлинения и терминации цепи. К факторам элонгации
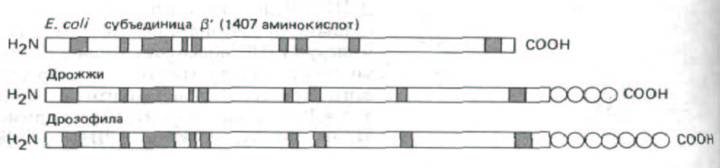
Рис. 9-64. Сходство аминокислотной последовательности бактериальных и эукариотических РНК-по-лимераз дает основание предположить, что эти ферменты имеют общее эволюционное происхождение. Полагают, что с ДНК связываются самые большие субъединицы РНК-полимераз из клеток Е. coli, дрожжей и дрозофилы (они сравниваются на рисунке). Закрашенные участки последовательности гомологичны более, чем на 70% у дрожжей и дрозофилы и более, чем на 40% -у дрозофилы и Е. coli. Показано, что на карбоксильном конце эукариотических субъединиц имеется уникальная последовательность Ser-Pro-Ser Туг-Scr-Pro-Thr, функция которой неизвестна: у дрожжей она повторяется 26 раз, а у лрозофилы-более 40 раз (обозначено кружками), (По A. Z. Green-leaf et al., In: RNA Polymerase and the Regulation of Transcription [W.S. Reznikoff et al., eds.] pp. 459-464. New York: Elsevier, 1987.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
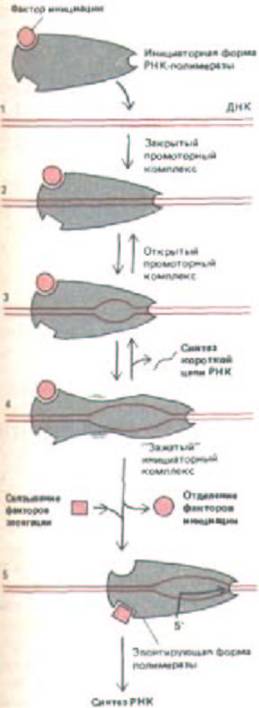
Рис. 9-65. Условная схема инициации синтеза РНК, катализируемого РНК-полимеразой. Указанные стадии выявлены при изучении фермента у Е. соlі. Показана молекула ДНК, несущая последовательность промотора для полимеразы Е. coli (см. рис. 5-6). Вначале фермент образует закрытый комплекс, в котором две цепи ДНК остаются спаренными по всей длине. На следующей стадии фермент катализирует открытие немногим более одного витка спирали ДНК, при этом образуется открытый комплекс, в котором матрица доступна для инициации синтеза цепи РНК. Полимераза, содержащая связанную с ней ситма-субъединицу, однако, ведет себя так, как будто она прикреплена к области промотора: она не способна осуществлять элонгацию цепи РНК и часто опять превращается в закрытый комплекс. Как показано на рисунке, для превращения фермента в полимеразу, активно осуществляющую элонгацию, необходимо, чтобы от него отделились факторы инициации {в случае Е. coli- сигма-
фактора) и присоединились другие белки, выполняющие роль факторов элонгации (например, белок nusA у Е. coli). (С изменениями по D.C. Staney and D. M. Crothers, J. Мо.. Biol. 193: 267-278, 1987.)
относится несколько белков, свойства которых хорошо изучены, хотя еще не совсем ясно, как они действуют.
У всех организмов различные гены транскрибируются с разной скоростью. На некоторых промоторах новая цепь РНК инициируется каждые 1-2 секунды, тогда как на других для начала синтеза РНК требуется час. Обычно уровень транскрипции каждого гена определяется белками-регуляторами генетической активности, влияющими на инициацию транскрипции (гл. 10). В целом, действие этих белков основано на ускорении или замедлении одной или более стадий, указанных на рис. 9-65.
9.4.2. Синтез РНК у эукариот осуществляют три различные РНК-полимеразы [43]
Хотя транскрипция у эукариот и такого прокариота, как Е.coli, в чем-то схожа, в эукариотических клетках этот механизм гораздо сложнее. И у дрожжей, и у человека имеется три типа РНК-полимераз, каждый из которых ответствен за транскрипцию разных генов. Структура этих ферментов, обозначенных как РНК-полимеразы I, II и III, близка, некоторые их субъединицы одинаковы, а некоторые отличаются (рис. 9-66).
Каждый из них сложнее РНК-полимеразы E.coli и, как полагают, содержит 10 или более полипептидных цепей. Наиболее важное различие между бактериальными и эукариотическими РНК-полимеразами состоит в следующем. У бактерий этот фермент связывается непосредственно с промотором, а у эукариот РНК-полимеразы присоединяются к промоторам только в присутствии дополнительных белковых факторов. Отчасти по этой причине лишь в 1979 г. удалось разработать системы, позволяющие изучать механизм инициации транскрипции у эукариот in vitro.
Изначально три эукариотические РНК-полимеразы были идентифицированы на основании различия в их чувствительности к а-аманитину, высокотоксичному веществу, выделенному из бледной поганки. Как оказалось, а-аманитин не действует на РНК-полимеразу I, РНК-полимераза II к нему очень чувствительна, а у РНК-полимеразы III этот признак выражен умеренно. Чувствительность синтеза РНК к а-аманитину до сих пор используется для определения того, какой именно полимеразой транскрибируется ген. Так было установлено, что только РНК-полимераза II
транскрибирует гены, РНК которых затем транслируется в белки. Две другие полимеразы синтезируют лишь те РНК, которые имеют структурные или каталитические функции: РНК-по-
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
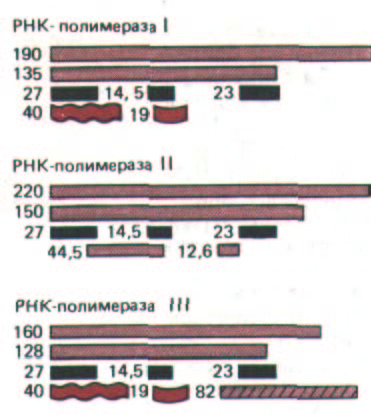
Рис. 9-66. Некоторые белковые субъединицы, входящие в состав трех эукариотических РНК-полиме-раз дрожжей. Показаны лишь наиболее хорошо изученные субъединицы. Родственные субъединицы окрашены одинаково, их молекулярная масса приведена в килодаль-тонах.
Все три фермента имеют три субъединицы с одинаковой массой (выделены черным).
лимераза 1 синтезирует большие рибосомные РНК, РНК-полимераза III - разнообразные короткие стабильные РНК, включая малую рибосомную 5S-PHK и транспортные РНК. Однако большая часть малых РНК, образующих мяРНК, синтезируются полимеразой II.
В клетках млекопитающих обычно содержится около 40 000 молекул РНК-полимеразы II, примерно такое же число РНК-полимеразы I и приблизительно 20000 молекул РНК-полимеразы III. Изучение культивируемых клеток показало, что концентрация РНК-полимераз регулируется no-отдельности, в зависимости от скорости роста клетки.
9.4.3. Факторы транскрипции образуют стабильные комплексы на эукариотических промоторах [44]
Как отмечалось выше, РНК-полимеразы эукариот не узнают свои промоторы на очищенных молекулах ДНК. Чтобы это произошло, с ДНК должны связаться один или более сайт-специфических белков. Такие белки называют факторами транскрипции (TF). Они отличаются от сигма-факторов прокариот (а-факторы) тем, что могут связываться с ДНК независимо от РНК-полимеразы. Полимеразы I, II и III требуют присутствия разных факторов транскрипции, обозначенных TFI, TFII и TFIII соответственно. Латинская буква, которая обычно следует за римской цифрой в названии фактора транскрипции, указывает, каким по счету был выделен данный фактор. Например, TFIIIA - это первый охарактеризованный фактор транскрипции, который действует на ген, транскрибируемый полимеразой III (ген 5S-pPHK).
По-видимому, in vitro факторы транскрипции образуют довольно стабильные транскрипционные комплексы, которые избирательно притягивают молекулы РНК-полимеразы к своим промоторам. Различные факторы присоединяются к ДНК в разных местах относительно положения сайта начала транскрипции. Полимераза I и полимераза II образуют комплекс с тем фактором транскрипции, который связывается непосредственно перед сайтом начала транскрипции. Между тем основной фактор транскрипции для генов, считываемых полимеразой III, присоединяется к ДНК сразу за сайтом начала транскрипции, и таким образом, РНК-полимеразе III приходится осуществлять свою функцию, не смещая этот белок с ДНК (рис. 9-67). Полагают, что данный фактор (TFIIIC) накручивает ДНК на себя, образуя большую нуклеопротеино-вую частицу.
О транскрипционной активности ДНК судят по её взаимодействию с РНК-полимеразой. При этом сравнивают молекулы ДНК, которые были предварительно проинкубированы с факторами транскрипции, и молекулы, не прошедшие такой обработки. Оказалось, что РНК-полимераза охотно использует для синтеза РНК молекулы ДНК, связан-
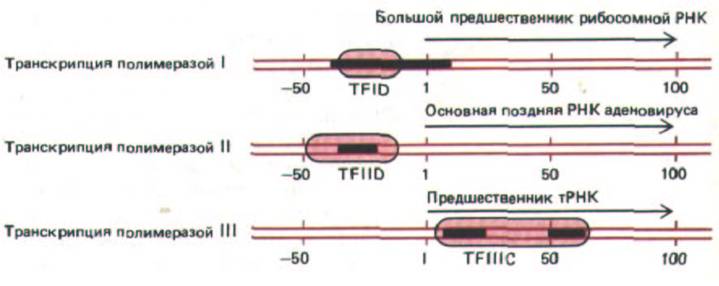
Рис. 9-67. Некоторые стабильные комплексы, образуемые факторами транскрипции с эукариотическими генами. Черным цветом
обозначены определенные последовательности ДНК, которые, как полагают, необходимы для функционирования промоторов. У каждого гена цветом выделены области, которые „закрываются" присоединившимися факторами (на основании данных футпринтинга ДНК, см. рис. 4-69).
Факторы транскрипции представляют собой молекулу белка, которая, вероятно, состоит из нескольких субъединиц, хотя доподлинно строение этих факторов неизвестно. Цифрами обозначено положение на молекуле ДНК (в нуклеотидных парах) относительно сайта начала транскрипции, принятого за +1.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
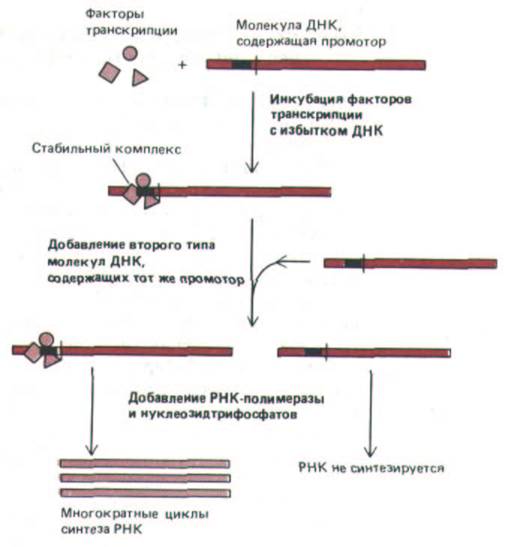
Рис. 9-68. Опыты in vitro, демонстрирующие важность образования стабильного транскрипционного комплекса на эукариотическом промоторе. Эксперименты проводили с факторами транскрипции и с промоторами, специфичными к каждой из трех эукариотических РНК-
полимераз. Примеры клонированных генов, используемых в этих опытах, представлены на рис. 9-67.
ные с определенными факторами, тогда как во втором случае, хотя сами по себе молекулы ДНК идентичны первым, связывания РНК-полимеразы не происходит (рис. 9-68). Аналогичная ситуация характерна для молекул ДНК, инъецированных в ооцит Хепорт, следовательно, такой же механизм действует и in vivo.
Важным фактором транскрипции для многих промоторов РНК-полимеразы II служит TFI1D. Он представляет собой большой белковый комплекс, который обычно называют ТАТА-фактор, так как он может связываться с консервативной АТ-богатой последовательностью, называемой ТАТА-бокс, которая расположена примерно за 25 нуклеотидов до сайта начала транскрипции. Механизм действия ТАТА-фактора, стимулирующего транскрипцию полимеразой II, представлен на рис. 9-69.
В связи с тем, что именно РНК-полимераза II отвечает за образование всех предшественников мРНК, и таким образом определяет, какие конкретно белки будут образовываться в клетке, в дальнейшем мы будем обсуждать синтез и судьбу транскриптов РНК, синтезируемых только этим ферментом
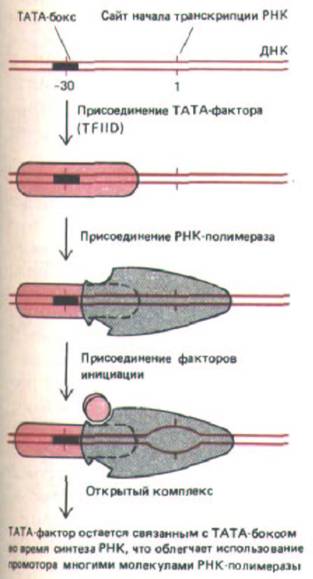
Рис. 9-69. Минимальные условия для узнавания промотора молекулой эукариотической РНК-полимеразы II. Чтобы промотор был узнан полимеразой, необходимо, чтобы фактор связывания с ТАТА-боксом (TFIID) образовал стабильный транскрипционный комплекс. Консенсусная последовательность ТАТА-бокса следующая: Т82А97Т93А85 (А или Т)83; числа указывают на вероятность (в процентах) присутствия указанного нуклеотида. См. также рис. 10-27. (По J.2. Workman and R.G. Roeder, Cell 51: 613-622, 1987.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 9-70. Электронная микрофотография типичного препарата клеточного ядра. Видна невероятно сложная сеть из переплетенных нитей хроматина, высвободившегося из подвергнутого лизису ядра. Лишь на самом краю этой сети хроматин имеет достаточно низкую плотность, чтобы его можно было исследовать при большом увеличении. (С любезного разрешения Victoria Foe.)
9.4.4. РНК-полимераза ll транскрибирует некоторые последовательности ДНК гораздо чаще других [45]
Эксперименты, проводимые с очищенными препаратами подимераз и факторами транскрипции in vitro, безусловно важны для изучения условий протекания транскрипционных процессов, однако многие сведения о транскрипции ДНК могут быть получены только с помощью электронной микроскопии, которая позволяет наблюдать активные гены вместе с транскрибирующей их РНК-полимеразой.
Обычная электронная микроскопия тонких срезов выявляет лишь гранулированные глыбки хроматина, указывая на наличие развитой внутриядерной структуры (рис. 9-100), но дает очень мало информации о том, как именно транскрибируются гены. Гораздо более информативны в этом отношении снимки изолированного ядерного содержимого, непосредственно наносимого на электронномикроскопическую сеточку после разрушения ядер (рис. 9-70 и 9-71). На достаточном удалении от центра разрушенного ядра концентрация хроматина относительно низка, что позволяет рассмотреть индивидуальные хроматиновые фибриллы, имеющие характерный вид «бус на нитке».
Транскрипционно активные молекулы РНК-полимеразы выглядят как большие глобулярные частицы, за каждой из которых тянется длинная молекула новосантезированной РНК. При этом молекулы РНК-полимеразы II, как правило, представлены одиночными частицами. Это свидетельствует о том, что большинство генов транскрибируется в предшественники мРНК относительно редко, так что одна РНК-полимераза успевает завершить транскрипцию до того момента, когда ее начнет следующая. Впрочем, в некоторых случаях можно увидеть множество РНК-
полимеразных частиц (и РНК-транскриптов), собранных в одном месте. Подобные кластеры типичны лишь для относительно небольшого числа генов, транскрибирующихся с высокой частотой (рис. 9-72). Длина молекул РНК, прикрепленных к такому кластеру, увеличивается в направлении движения молекул полимеразы, что придает всей структуре характерный вид. Каждый такой участок несет специфические сигналы начала и окончания транскрипции для РНК-полимеразы II и представляет собой транскрипционную единицу (рис. 9-73).
Биохимические исследования подтвердили результаты, полученные с помощью электронной микроскопии и позволили сформулировать три основных вывода.
1. Эукариотические РНК-полимеразы, как и прокариотические ферменты, начинают и оканчивают транскрипцию лишь в определенных точках хромосомы.
2. Средняя длина новообразованной молекулы РНК, синтезированной РНК-полимеразой на транскрипционной единице, составляет около 8000 нуклеотидов, однако» не редкость и молекулы РНК, насчитывающие от 10 до 20000 нуклеотидов. Это намного больше, чем 1200 нуклеотидов, т. е, больше той величины, которая достаточна для синтеза средней белковой молекулы, содержащей 400 аминокислотных остатков; такая большая длина молекул РНК отражает особенности строения эукариотических генов, которые мы подробно обсудим в дальнейшем.
3. Хотя большая скорость удлинения цепи (около 30 нуклеотидов в секунду) характерна для всех РНК, различные точки начала транскрипции для РНК-полимеразы II обладают очень разной эффективностью, и, таким образом, одни гены транскрибируются гораздо быстрее других. Данные электронномикроскопического исследования хорошо согласуются с результатами биохимического анализа, которые свидетельствуют
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
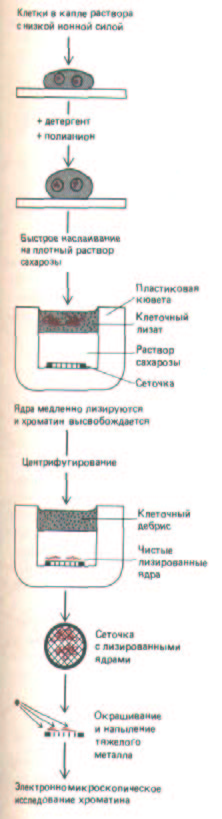
Рис. 9-71. Метод электронномикроскопического исследования хроматина, основанный на мягком лизисе и последующей очистке лизированного ядра от клеточных обломков.
о том, что хотя в клетке накапливается множество молекул мРНК различных типов, большая их часть представлена относительно малым числом копий (табл. 9-2).
9.4.5. Предшественники информационной РНК ковалентне модифицированы с обоих концов [46]
Транскрипты, синтезированные в ядре РНК-полимеразой II, называют гетерогенной ядерной РНК (гяРНК), поскольку важнейшим признаком, отличающим эти молекулы от других ядерных РНК, служит гетерогенность их размеров. Многие гетерогенные ядерные транскрипты впоследствии покинут ядро, превратившись в молекулы информационной или матричной РНК (мРНК). Однако прежде чем выйти из ядра, молекулы мРНК претерпевают серию ковалентных модификаций, наделяющих эти молекулы свойствами, которые отличают их от транскриптов, синтезированных всеми другими РНК-полимеразами. Эти модификации окажутся им необходимыми позже, при функционировании в качестве мРНК в цитоплазме.
5'-конец молекулы РНК (конец, синтезируемый при транскрипции первым) прежде всего кэпируется, т. е. достраивается с образованием особой структуры, ответственной за последующее связывание молекулы мРНК с рибосомой. Кэпирование (добавление метилированного G-нук-
леотида) происходит почти сразу после синтеза первых 30 нуклеотидов РНК и осуществляется путем соединения трифосфатной группы молекулы GTP с дифосфатом на 5'-конце первичного транскрипта (рис. 9-74). Помимо важной роли, которую играет 5'-кэп в инициации белкового синтеза, его функция состоит в том, чтобы защищать транскрипт РНК от деградации.
З'-конец большинства транскриптов, синтезируемых РНК-полимеразой II, образуется не в результате терминации транскрипции (соответствующий сайт расположен дальше), а в результате вторичной модификации, при которой растущий транскрипт расщепляется в определенном месте и к З'-концу в точке разреза специальная полимераза добавляет polyA-последователыюсть. Сигналом к разрезанию служит появление на цепи РНК участка AAUAAA (за 10-30 нуклеотидов до сайта расщепления) и еще одной, хуже изученной последовательности. Сделав разрез, фермент ро.уА-полимераза присоединяет от 100 до 200 остатков адени-ловой кислоты (так называемый роlуА-„хвост") к З'-концу цепи РНК, чем завершает образование первичного транскрипта РНК, А тем временем РНК-полимераза продолжает транскрипцию и делает это до тех пор, пока не встретит на своем пути сайт терминации. Но дополнительные фрагменты транскрипта РНК лишены кэпа и, вероятно, поэтому быстро распадаются (рис. 9-75).
Функция роlуА-„хвоста" до сих пор не очень ясна. Согласно одной из гипотез, эта последовательность участвует в транспорте зрелой мРНК из ядра. Имеются также данные, свидетельствующие о том, что polyA-конец замедляет деградацию в цитоплазме некоторых молекул мРНК, что способствует их стабилизации.
Хотя транскрипты, синтезированные РНК-полимеразой II, составляют более половины РНК, образующейся в клетке, мы уже убедились в том, что большая часть РНК этих транскриптов нестабильна и, следовательно, существует в клетке недолго. В итоге, гяРНК, содержащаяся в ядре, и образовавшаяся из нее цитоплазматическая мРНК составляют лишь малую часть всей РНК клетки (табл. 9-3). Несмотря на то, что молекулы гяРНК относительно редки, выделить их довольно легко благодаря присутствию на З'-конце длинной ро.уА-последователь-ности. Если пропустить всю РНК клетки через колонку, заполненную
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 898; Нарушение авторских прав?; Мы поможем в написании вашей работы!