
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Многие клетки образуют на своей поверхности подвижные структуры, содержащие актин, - микрошипы и
11-12
11-11
11.2.9. Рост актинового филамента происходит главным образом на плюс-конце [25]
Как уже упоминалось, in vitro молекулы актина могут спонтанно полимеризоваться в присутствии АТР, образуя филаменты. Обычно этот процесс инициируют повышением ионной силы раствора актина, а следить за его протеканием проще всего, измеряя увеличение светорассеяния раствора или флуоресценции ковалентне связанного красителя. Полимеризация актина развивается нелинейно - вначале наблюдается лаг-фаза, отражающая первую стадию, самую медленную и затрудненную, в которой три молекулы актина должны соединиться в определенной геометрической конфигурации (рис. 11-39). Эта стадия называется нуклеациеп. Когда нуклеация произошла, дальнейшее присоединение новых молекул актина к концам филамента происходит быстро. Процесс сборки филаментов обратим, и в конце концов концентрация мономеров падает до уровня, при котором скорости ассоциации и диссоциации мономеров становятся равными. Такую концентрацию называют критической. Если быстро разбавить раствор актина так, чтобы концентрация мономеров упала ниже критической, актиновые филаменты начнут распадаться, и их деполимеризация будет продолжаться до тех пор, пока не восстановится критическая концентрация мономеров. Как мы увидим, и нуклеация, и полимеризация актина в клетке находятся под контролем различных актин-связывающих белков, которые и определяют таким образом местоположение и длину актиновых филаментов. У полимеризации актина есть еще одна особенность, которая позволяет объяснить направленность роста филаментов при осуществле-
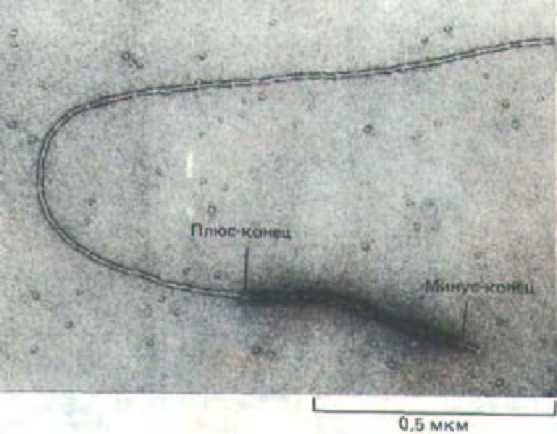
Рис. 11-40. Асимметричный рост актинового филамента. Если в качестве «затравки» для полимеризации актина использовать небольшие фрагменты актиновых нитей, помеченных головками миозина, можно увидеть, что сборка происходит гораздо быстрее на плюс-конце первоначального фрагмента, чем на минус-конце. (С любезного разрешения M.S. Runge, Т. D. Pollard.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
нии различных клеточных движений. Как мы уже достаточно хорошо знаем, актиновые филаменты обладают полярностью, и важное следствие этой полярности - различная кинетика полимеризации плюс- и минус-концах. Это различие можно обнаружить, если пометить небольшой участок актинового филамента миозиновыми головками, а затем добавить к ним мономеры актина в условиях, благоприятных для полимеризации.
Зафиксировав через некоторое время растущие актиновые филаменты, можно под электронным микроскопом увидеть, что их плюс-концы выросли гораздо больше, чем минус-концы (рис, 11-40). Проведя серию таких экспериментов, можно измерить скорость роста обоих концов филамента при различных концентрациях актиновых мономеров. В среде, соответствующей по ионному составу внутриклеточным условиям, очищенные актиновые филаменты растут на плюс-концах в 5-Ю раз быстрее, чем на минус-концах. По-видимому, in vivol рост почти всегда происходит на плюс-конце; поэтому, закрепив плюс-конец филамента в определенной ориентации, клетка может предопределить скорость и направление роста филамента.
11.2.10. В актиновых филаментах происходит «тредмиллинг» составляющих их субъединиц [25]
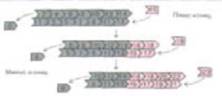
Эксперименты in vitro (вроде показанного на рис. 11-40) говорят о том, что концентрация актина, при которой рост филаментов прекращается, т. е. критическая концентрация, различна для разных концов филамента. Поэтому при полимеризации актина в пробирке достигается стационарное состояние, в котором присоединение мономеров происходит в основном на плюс-конце, а их отделение - на минус-конце. Скорости этих двух процессов в стационарном состоянии одинаковы, и потому концентрация свободных мономеров остается постоянной. Хотя общая длина полимера при этом не изменяется, отдельные молекулы актина непрерывно перемещаются от одного конца филамента к другому (рис. 11-41). Этот процесс, получивший название тредмиллинга, можно сравнить с продвижением людей в очереди.
Для тредмиллинга необходима энергия, иначе на его основе можно
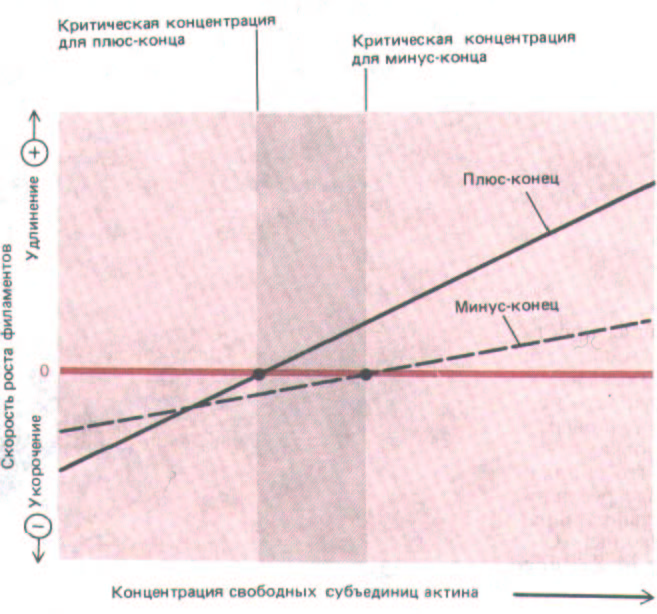
Рис. 11-41. Скорость роста актиновых филаментов на разных концах при различных концентрациях мономеров актина. График показывает, что два конца растут с разными скоростями и критические концентрации для них различны. Поэтому существует некоторый диапазон концентраций свободного актина (темная полоса), при которых плюс-конец актинового филамента полимеризуется, а минус-конец деполимеризуется. Когда in vitro свободный актин находится в равновесии с актиновыми филаментами, в целом роста не происходит, так как скорости отделения молекул от минус-конца и присоединения их к плюс-концу равны. При такой концентрации свободных актиновых субъединиц (промежуточной между критическими концентрациями для двух концов-показано цветной стрелкой) длина филаментов не изменяется, но молекулы актина в них все время движутся от одного конца полимера к другому. Этот процесс называют тредмил-лингом (см. схему 11-1).
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
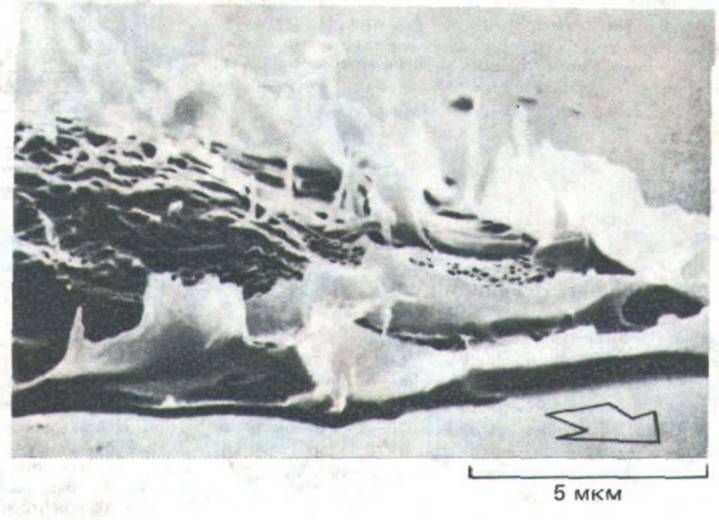
Рис. 11-42. Ламеллоподии и микро-шипы на переднем крае человеческого фибробласта, передвигающегося в культуре (микрофотография, ученная с помощью сканирующего электронного микроскопа). Стрелкой указано направление движения. По мере того как клетка продвигается вперед, ламеллоподии и микрошипы перемещаются назад' по ее верхней стороне, что создает картину «раффлинга». (С любезного разрешения Julian Heath.)
было бы создать вечный двигатель - машину, способную совершать работу, не расходуя энергии, т. е. нарушая законы термодинамики. В случае тредмиллинга энергию доставляет гидролиз АТР: каждый мономер актина связывает молекулу АТР, которую после своего присоединения к филаменту быстро гидролизует до ADP и фосфата. Каким образом гидролиз АТР делает возможным тредмиллинг, объясняется на схеме 11-1.
Вскоре мы увидим (разд. 11.2.11), что тредмиллинг может быть одним из механизмов, с помощью которого актиновые нити и связанные с ними компоненты выполняют в клетке двигательные функции.
ламеллоподии [26]
Динамичные выступы клеточной поверхности с актиновыми филаментами внутри - весьма обычная черта животных клеток, особенно тех, которые в данный момент мигрируют или изменяют свою форму. Культивируемые клетки, например, часто образуют множество тонких жестких выростов толщиной около 0,1 мкм и длиной 5-10 мкм, называемых микрошипами, которые содержат рыхлые пучки примерно из 20
актиновых филаментов, ориентированных плюс-концами наружу. Растущий конец аксона нервной клетки-конус роста - выпускает еще более длинные микрошипы - филоподии, длина которых может достигать 50 мкм (разд. 19.7.7). Эти выступы клеточной поверхности весьма подвижны, они могут очень быстро появляться и исчезать. Видимо, они действуют подобно щупальцам, которыми клетка исследует окружающее пространство; те микрошипы, которые прочно прикрепляются к какому-то субстрату, направляют движущуюся клетку к этому более адгезивному участку, а те, которым прикрепиться не удалось, перемещаются.по верхней стороне клетки назад и там втягиваются.
Помимо микрошипов ползущие клетки и конусы роста периодически выбрасывают из своего активно продвигающегося («переднего»)
края тонкие пластинчатые отростки, получившие название ламеллоподии. Как и микрошипы, одни ламеллоподии успешно прикрепляются к субстрату,
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
СКОРОСТИ РОСТА НА ПЛЮС- И МИНУС-КОНЦАХ РАЗЛИЧНЫ Сборка (полимеризация) и разборка (деполимеризация) актиновых филаментов осуществляются путем присоединения и отделения мономеров на концах филамента. В процессе сборки фипамент растет на одном из концов быстрее, чем на другом; быстро растущий конец называют плюс-концом, а медленно растущий - минус-концом. Различие в скоростях роста противоположных концов обусловлено тем, что каждая субъединица, присоединяясь к полимеру, изменяет свою конформацию.
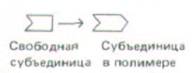
Это конформационное изменение влияет на присоединение субъединицы преимущественно на одном из концов.

КРИТИЧЕСКАЯ КОНЦЕНТРАЦИЯ СУБЪЕДИНИЦ Число субъединиц, присоединяющихся к полимеру за 1 с, пропорционально концентрации свободных субъединиц (kacc. [C]); в то же время субъединицы диссоциируют от концов полимера с постоянной скоростью (k дисс), от [ С ] не зависящей. По мере роста полимера свободные субъединицы расходуются и [С] снижается до тех пор, пока не достигает постоянной величины — критической концентрации (Сc), при которой скорость присоединения субъединиц к полимеру равна скорости их отделения от него. В этом состоянии равновесия kасс. Сс = kдисс., откуда 

И хотя значения kасс и kдисс для плюс- и минус-концов будут различны, их отношения kдисс/kасс значит и Сс, должны быть одинаковы на обоих концах. Это обусловлено тем, что при отделении субъединицы от любого конца полимера разрушаются совершенно одинаковые связи, а конечные состояния субъединиц после этого тоже идентичны. Таким образом, изменение свободной энергии ДС при отделении субъединицы, определяющее константу равновесия для ассоциации субъединицы С концом (см. табл. 3-3), на обоих концах одно и то же; если плюс-конец растет вчетверо быстрее, чем минус-конец, то и укорачиваться он должен тоже вчетверо быстрее.
Итак, при [С] <С0 оба конца растут;
при [С 1 > С0 оба конца укорачиваются (см. рис. 11 41)
ГИДРОЛИЗ АТР ПРИВОДИТ К ИЗМЕНЕНИЮ КОНСТАНТЫ РАСНОВЕСИЯ НА КАЖДОМ ИЗ КОНЦОВ Каждая молекула актина несет прочно связанную молекулу АТР. Вскоре после коформационного изменения субъединицы актина при ее присоеди-нии к полимеру этот АТР гидролизуется до ADP. который остается прочно связанным с актином.

Гидролиз АТР уменьшает сродство субъединицы к соседним субъединицами и тем самым увеличивает вероятность ее отделения от любого конца. Обычно присоединяется к филаменту форма  , а покидает его форма
, а покидает его форма  (которая затем в растворе превращается в
(которая затем в растворе превращается в  , так что процесс отделения субъединицы от полимера не является просто обращением реакции присоединения.
, так что процесс отделения субъединицы от полимера не является просто обращением реакции присоединения.
Расмотрим события, происходящие на плюс-конце:
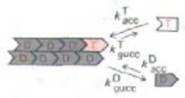
Как и прежде, полимер будет расти, пока [ С ] не снизится до СС. Для большей наглядности мы можем Пренебречь величинами kасс и kдисс как малый; рост полимера прекратится при kacc. CC = kдисс., т.е. С0 = kдисс./kасс. = 1/К Это не истинное равновесие, а стационарное состояние, поскольку гидролизованный АТР должен быть восполнен путем обмена нуклеотидов на свободной субъединице ( →
→  )
)
ТРЕДМИЛЛИНГ Так как kасс и kдисс относятся к различным реакциям, их отношение kдисс/kасс не обязательно будет одинаковым на разных концах полимера.
Действительно, оказалось, что гидролиз АТР создает для противоположных концов различные критические концентрации, причем Сс (для минус-конца) > сс (для плюс-конца).
Если оба конца полимера "открыты", полимеризация будет преобладать, пока [С] не достигнет некоторого уровня выше С для плюс-
конца и ниже Сс для минус-конца (см. рис. 11-14). В этом стационарном состоянии нз •плюс-конце будет идти сборка субьединиц в полимер, а на минус-конце — разборка полимера, причем скорости этих процессов будут одинаковы, так что длина полимера не будет изменяться, несмотря на перемещение субъединиц в полимере — тредмиллинг:
Для сборки филаментов гидролиз АТР не нужен. В подходящих условиях полимеризуются и мономеры актина, несущие негидролизуемый аналог АТР. Однако образующиеся при этом филаменты не способны к тредмиллингу - он возможен лишь благодаря гидролизу АТР, который сопутствует полимеризации.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
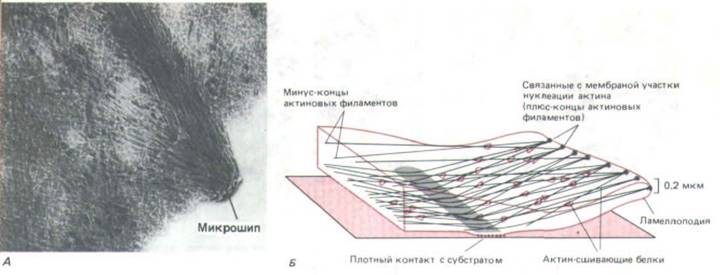
Рис. 11-43. Актиновые филаменты в переднем крае культивируемого фибробласта. А. Электронная микрофотография цельного переднего края клетки, экстрагированной неионным детергентом для удаления плазматической мембраны и основной массы растворимых белков. Обратите внимание на ориентированную сетку актиновых филаментов в ламеллоподии, в которую погружен микрошип. Б. Схема расположения актиновых филаментов ламеллоподии. (А-J.V. Small, J. Cell Biol. 91: 695-705, 1981. С разрешения Rockefeller University Press.)
другие же «соскальзывают» и в этом случае тоже волнообразно перемещаются назад по верхней поверхности клетки - этот процесс получил название «раффлинга» (ruffling-волнение, рябь) (рис. 11-42).
Ламеллоподию можно рассматривать как двумерный вариант микрошипа; на ее переднем крае нередко находится ряд коротких микрошипов. Если клетку осторожно зафиксировать и окрасить для электронной микроскопии, актиновые филаменты в ламеллоподиях двигавшейся клетки будут выглядеть гораздо более организованными, чем в других участках кортекса; упорядоченные группы филаментов вытянуты к переднему краю, где их плюс-концы упираются в плазматическую мембрану (рис. 11-43).
Исследование движущихся клеток в культуре показывает, что тредмиллинг мономеров в актиновых филаментах на переднем крае клетки идет гораздо быстрее, чем в филаментах, образованных in vitro. Движение молекул актина в клетке можно выявить в экспериментах с «гашением»
флуоресценции. Если флуоресцентно меченные молекулы актина инъецировать в движущуюся клетку, они быстро включаются во все актиновые филаменты. Если теперь с помощью лазерного луча разрушить флуоресцирующую метку в небольшом пятнышке на тонком переднем крае клетки, то можно увидеть, как это темное пятнышко постепенно перемещается от края клетки внутрь со скоростью около 0,8 мкм/мин, что указывает на быстрый тредмиллинг молекул актина в филаментах ламеллоподии и микрошипов (рис. 11-44). Очевидно, мономеры актина все время присоединяются к плюс-концам у плазматической мембраны и отделяются от минус-концов в глубине клетки.
Если таким же образом погасить флуоресценцию актиновых филаментов на небольшом участке в любой другой области клетки, свечение через несколько минут восстановится без всякого видимого перемещения: очевидно, в организации или поведении актина в переднем крае клетки есть какие-то особенности. Было высказано предположение, что непрерывная полимеризация актина непосредственно под плазматической мембраной может использоваться для вытягивания переднего края клетки и помогать тем самым ее движению вперед (см. разд. 11.6.5). Изучение механизма перемещения спермиев некоторых беспозвоночных действительно показало участие в этом процессе полимеризации актина.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
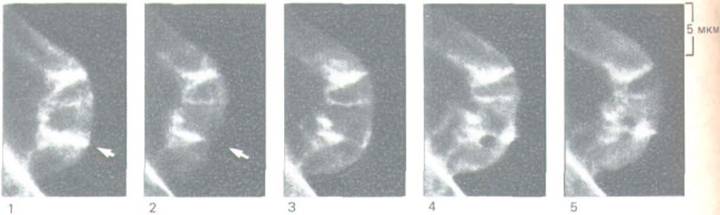
Рис. 11 -44. Тредмиллинг актина в культивируемых фибробластах. Флуоресцирующие молекулы актина были введены путем микроинъекции в клетку, где они включились в актиновые филаменты. Небольшое пятнышко на актиновом филаменте в переднем крае клетки было «погашено» лучом лазера. Затем клетку фотографировали через определенные промежутки времени при помощи флуоресцентного микроскопа с видеоприставкой (разд. 4.1.6). Быстрое перемещение пригашенного пятна назад говорит о том, что молекулы актина непрерывно движутся по филаменту, удаляясь от переднего края.
|
|
Дата добавления: 2015-08-31; Просмотров: 850; Нарушение авторских прав?; Мы поможем в написании вашей работы!