
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
И в гладкомышечных, и в немышечных клетках миозин активируется фосфорилированием его легких
|
|
|
|
цепей [12]
Высокоспециализированные сократительные механизмы мышечных клеток, которые мы здесь рассмотрели, произошли от более простых силовых механизмов, имеющихся во всех эукариотических клетках. В связи с этим неудивительно то, что миозин немышечных клеток наиболее сходен с миозином гладких мышц - наименее специализированного типа мускулатуры. В клетках этого типа сокращение запускается повышением концентрации Са2 + в цитозоле (так же как и в клетках сердечной и скелетных мышц), однако ионы Са2 + действуют тут не через тропонин-
тропомиозиновый комплекс. Инициация сокращения происходит главным образом за счет фосфорилирования одной из двух цепей молекулы миозина, что контролирует взаимодействие миозина с актином.
Две легкие цепи миозина, входящие в состав каждой миозиновой головки (см. рис. 11-9), неодинаковы, и при сокращении гладкомышечных и немышечных клеток фосфорилируется лишь одна из них. Когда она фосфорилирована, головка миозина может взаимодействовать с актиновым филаментом, что приводит к сокращению; при дефосфорилировании этой легкой цепи миозиновая головка стремится отделиться от актина, становясь тем самым неактивной. Это фосфорилирование катализируется специальным ферментом - киназоп
легких цепей миозина, которая становится активной, лишь связываясь с комплексом Са2 +-кальмодулин (разд. 12.4.3). Таким образом, сокращение здесь тоже находится под контролем концентрации Са2+ в цитозоле (рис. 11-24). Фосфорилирование происходит сравнительно медленно, так что максимальное сокращение развивается нередко за время порядка секунды (в поперечнополосатых мышцах - за несколько миллисекунд), но для гладкомышечных и немышечных клеток быстрая активация сокращения и не нужна.
|
|
|
Миозин этих клеток гидролизует АТР примерно в 10 раз медленнее, чем миозин скелетных мышц, что отражается, естественно, на скорости «шагания» его по актиновым филаментам и быстроте сокращения в целом. Однако не следует рассматривать гладкомышечные клетки как

Рис. 11-24. Сокращение гладкой мышцы активируется в присутствии Са2+ с помощью киназы легких цепей миозина, фосфорилирующей определенный участок одного из двух типов легких цепей в миозине. Регуляция немышечного миозина осуществляется таким же образом (см. рис.
11-25).
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
«плохой», медленно работающий вариант клеток скелетных мышц, пригодный на что-то только потому, что к этим клеткам предъявляется меньше требований. Они специально приспособлены для медленного продолжительного сокращения и способны поддерживать напряжение длительное время, гидролизуя при этом в 5-10 раз меньше АТР, чем требовалось бы для выполнения такой же задачи клеткам скелетных мышц. Кроме того, сокращение гладких мышц контролируется большим набором разнообразных сигналов, в том числе импульсами, приходящими от вегетативной нервной системы, и гормонами (например, адреналином). Многие из этих сигналов действуют через киназу легких цепей миозина. Так, во многих клетках адреналин, повышая уровень циклического AMP, вызывает фосфорилирование этой киназы, что резко уменьшает ее сродство к Са2+-
кальмодулиновому комплексу; тем самым адреналин ингибирует фосфорилирование легких цепей миозина, заставляя гладкомышечную клетку расслабляться.
11.1.16. При фосфорилировании легких цепей немышечный миозив способен объединяться в филаменты [13]
|
|
|
Хотя миозин есть практически во всех эукариотических клетках, стабильные толстые филаменты он образует только в сердечной и скелетных мышцах. Молекулы миозина в немышечных клетках собраны в меньшие комплексы в зависимости от обстоятельств; размеры и местоположение этих сократительных систем определяются внутриклеточными сигналами. Важным фактором, регулирующим степень агрегации миозина, служит его фосфорилирование киназой легких цепей, которое влияет не только на АТРазную активность миозина, но также на его форму и способность к самосборке.
Если немышечный миозин дефосфорилировать путем обработки фосфатазой, он становится легко растворимым. Седиментационный анализ показал, что единичные молекулы растворимого миозина имеют компактную конфигурацию, и, судя по данным электронной микроскопии, каждый миозиновый хвост складывается с самим собой, цепляясь за «липкий участок» на головке. В этой свернутой конформации миозиновые молекулы не способны эффективно образовывать филаменты. Когда киназа легких цепей миозина фосфорилирует головки, они теряют «липкость», хвосты освобождаются, распрямляются и могут ассоциировать друг с другом, образуя биполярные миозиновые филаменты (рис. 11-25 и 11-26).
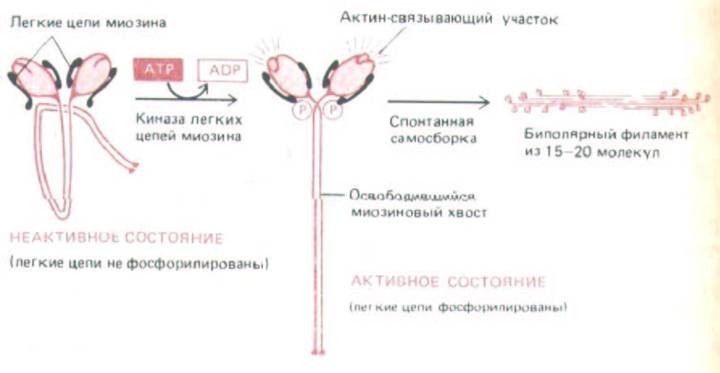
Рис. 11-25. Сборка филаментов немышечного миозина контролируется фосфорилированием его легких цепей. Фосфорилирование вызывает два эффекта: оно изменяет конформацию миозиновой головки таким образом, что на ней обнажается актин-связывающий участок, и высвобождает миозиновый хвост из «липкого кармана» на миозиновой головке, тем самым позволяя молекулам миозина объединяться в короткие биполярные филаменты. Точно так же ведет себя гладкомышечный миозин.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 11-26. Короткие филаменты немышечного миозина, образовавшиеся в результате фосфорилировання его легких цепей (электронная микрофотография, негативный контраст). (С любезного разрешения John Kendrick-Jones.)

Рис. 11-27. Примеры встречающихся в немышечных клетках сократительных пучков актиновых филаментов, в состав которых входит также миозин.
|
|
|
11.1.17. В немышечных клетках могут временно создаваться сократимые комплексы мышечного типа [14]
Для немышечных клеток контроль над сборкой и разборкой миозиновых комплексов имеет особое значение, так как в них сократительные структуры из актиновых филаментов и миозина нередко образуются лишь для выполнения какой-нибудь специальной функции, после чего снова разбираются. В частности, при делении клетки под ее мембраной появляется так называемое сократимое кольцо - поясок из актиновых филаментов и миозина. Именно за счет его сокращения посередине клетки образуется перетяжка, что ведет затем к разъединению двух дочерних клеток (рис. 11-27; см. также разд. 13.5.14). Поскольку сократительное кольцо не является постоянной клеточной структурой, оно должно формироваться в начале деления. Этот процесс можно наблюдать, окрашивая делящиеся клетки флуоресцентными антителами к миозину.
Например, в готовых к делению яйцах морского ежа молекулы миозина вначале равномерно распределены под плазматической мембраной, а затем, по мере образования сократительного кольца, мигрируют в экваториальную область; распределение их снова становится дисперсным, когда деление клетки завершилось. Каким образом этот процесс контролируется - неизвестно.
Другой пример временно существующих сократимых структур - это так называемые стрессовые волокна (или нити), характерные элементы цитоскелета культивируемых фибробластов (см. рис. 11-27). И по своей структуре, и по функциям они напоминают тонкие миофибриллы (рис. 11-28). Одним концом эти волокна связаны с плазматической мембраной в особых участках, называемых фокальными контактами (см. разд.
11.2.8), и похожи по составу и ультраструктуре на участки присоединения к плазматической мембране актиновых филаментов в клетках гладких мышц (см. рис. 11-23). Другим концом они связаны либо с густой сетью промежуточных филаментов, окружающей ядро клетки (см. рис. 9-1), либо с другим фокальным контактом. Стрессовые волокна образуются при механическом растяжении клетки (например, когда она распластывается по субстрату) и исчезают во время митоза, когда клетка округляется и теряет связь с субстратом. Если ликвидировать натяжение, «оторвав» лазерным лучом один конец стрессового волокна от фокального контакта, оторванное волокно тоже быстро исчезнет. Стрессовые волокна фибробластов, находящихся в тканях, судя по всему, способны сокращаться, передавая создаваемое усилие на окружающий коллагеновый матрикс; этот процесс играет большую роль в заживлении ран и в морфогенезе.
|
|
|
Некоторые сократительные структуры на основе актиновых фила-
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 11-28. Электронная микрофотография фибробласта в культуре (окраска антителами, меченными коллоидным золотом). Видно, что организация белков в стрессовых волокнах напоминает мышечную. Показано расположение двух типов актин-связывающих белков: α-актинин (крупные частицы золота) ассоциирован с периодически повторяющимися плотными участками в стрессовых волокнах (в поперечнополосатой мышце α -актинин находится в Z-дисках), тогда как головки миозина (мелкие частицы золота) видны по обе стороны от полос с а-актинином. Такая организация имеет некоторое сходство с саркомером (сравните с рис. 11-2) и указывает на то, что молекулы миозина здесь собраны в филаменты.
(Фото любезно предоставлено М. de Brabander, J. de Mey, G. Langanger.)
ментов оказываются более долгоживущими. Таковы, например, кольце вые пучки актиновых филаментов в опоясывающих десмосомах, расположенных вблизи апикальной поверхности клеток эпителия (разд. 14.1.3). Среди прочих функций, эти пучки, видимо, играют важную роль в изгибании эпителиальных пластов в ходе эмбриогенеза (разд. 11.6.9).
11.1.18. Мышечные белки кодируются генами, составляющими мультигенные семейства [15]
Как мы видели, в мышечных клетках всех трех типов, а также в немышечных клетках сократительный аппарат имеет много общих черт, Различные типы сокращения, свойственные разным клеткам, отчасти определяются тканеспецифичностью экспрессии генов, кодирующих белки этого аппарата. У млекопитающих, например, имеются по меньшей мере шесть генов актина, шесть генов тяжелой цепи миозина, три тропомиозиновых гена и три гена тропонина Т. В некоторых случаях кодируемые разными генами белки несколько различаются по функции в других же случаях функциональных различий пока не обнаружено.
Из шести вариантов актина, экспрессируемых у млекопитающих один содержится только в скелетных мышцах, другой - в сердечной мышце, а еще два - только в гладкомышечных клетках (первый из них - в гладкой мускулатуре сосудов, а второй в мускулатуре других органов); и наконец, два последних варианта, известные как немышечные, или цитоплазматические, актины, являются, по-видимому, универсальными компонентами цитоскелета и в значительных количествах присутствуют в большинстве немышечных клеток. Все эти виды, или изоформы, актина очень сходны по аминокислотным последовательностям; например, мышечные актины отличаются от цитоплазматических менее чем по 7%
аминокислот. Если не считать некоторых различий в N-концевой части молекулы, возможно, влияющих на процесс полимеризации актина, не ясно, имеют ли такие различия какое-либо функциональное значение, Экспрессия гена «сердечного» актина в культивируемых фибробластах не изменяет ни форму, ни поведение клеток, и синтезируемый белок легко включается в их нормальные актиновые структуры. Напротив, различия между миозинами влияют и на скорость сокращения, и на его регуляцию, а также на степень ассоциации молекул миозина в клетке.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
11.1.19. Разнообразие мышечных белков увеличивается за счет альтернативных способов сплайсинга их мРНК [16]
Все сказанное выше о различных типах мышц дает лишь частичное представление об их реально существующем разнообразии. В скелетных мышцах взрослого человека, например, мы находим смесь мышечных клеток трех типов: белые мышечные клетки, приспособленные для быстрого анаэробного сокращения (АТР синтезируется в них в основном за счет гликолиза); красные мышечные клетки, специализированные для медленного и более продолжительного сокращения и использующие главным образом аэробный метаболизм (их цвет обусловлен высокой концентрацией запасающего кислород белка - миоглобина); и наконец, мышечные клетки промежуточного типа, синтезирующие АТР как аэробным, так и анаэробным путем (разд. 2.3.2). В каждом из этих типов есть еще подтипы, с помощью которых происходит «тонкая настройка»
каждой мышцы на выполнение характерных для нее физиологических функций и на соответствующий метаболизм. При этом одни и те же мышцы у взрослого человека и у плода различны.
Белковый состав каждого из этих типов мышц имеет свои особенности. Очень важным источником разнообразия служит тканеспецифическая регуляция сплайсинга пре-мРНК, позволяющая комбинировать различные наборы экзонов, так что продуктами одного гена могут быть несколько слегка различающихся молекул мРНК (разд. 10.4.2). Характер сплайсинга пре-мРНК может изменяться под действием гормональных, нервных и иных факторов, и в результате изменяются аминокислотные последовательности определенных мышечных белков в зависимости от ткани и стадии онтогенеза. Например, ген тропонина Т, который экспрессируется в скелетных мышцах, благодаря альтернативному сплайсингу РНК дает по меньшей мере 10 различных форм белка. Эти варианты, вероятно, по-разному взаимодействуют с тропонином С и тропомиозином, модифицируя таким образом регуляцию мышечного сокращения.
Заключение
Сокращение мышц происходит в результате скольжения актиновых филаментов вдоль миозиновых. Головки молекул миозина, выступающие по бокам миозиновых филаментов, осуществляют АТР-зависимый цикл, в котором присоединяются к соседним актиновым
филаментам, изменяют свою конформацию таким образом, что заставляют актиновые и миозиновые филаменты смещаться относительно друг
друга, а затем снова отделяются от нитей актина. Эффективной работе этого цикла способствуют специальные вспомогательные белки, которые поддерживают пространственную организацию актиновых и миозиновых филаментов в виде параллельных, частично перекрывающихся
пучков с правильной взаимной ориентацией и оптимальным расстоянием между ними. Еще два вспомогательных белка-тропонин и тропомиозин-
обеспечивают регуляцию сокращения скелетных и сердечной мышц ионами Са2 +.
Актин и миозин присутствуют также и в гладких мышцах, и в большинстве немышечных клеток. Сокращение в них осуществляется по
тому же принципу, что и в сердечной и скелетных мышцах, но элементарные сократимые блоки здесь мельче и не обладают столь высокой
степенью упорядоченности; кроме того, их активность и степень ассоциации находятся под контролем Са2 + -зависимого фосфорилирования
одной из легких цепей миозина.
Сократительный аппарат мышечных и немышечных клеток точно настроен на выполнение специфических функций в зависимости от
Типа
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
клеток. Это определяется тканеспецифическоп экспрессией различных генов, кодирующих мышечные белки, и тканеспецифической же регуляцией
сплайсинга мРНК, благодаря которой один ген может давать слегка различающиеся варианты белков.
11.2. Актиновые филаменты и клеточный кортекс [17]
Во многих эукариотических клетках актин содержится в больших количествах, составляя нередко до 5% и более от общего белка клетки.
Хотя он распределен по всей цитоплазме, в большинстве животных клеток существует особенно густая сеть из актиновых филаментов и ассоциированных с ними белков под самой плазматической мембраной. Эта сеть образует клеточный кортекс, который придает механическую прочность поверхностному слою клетки и позволяет клетке изменять свою форму и двигаться. Структура кортекса может быть различной у разных клеток и даже в разных участках одной и той же клетки. Иногда это плотная трехмерная сеть из поперечносшитых актиновых филаментов, в которую не могут проникать органеллы и другие крупные частицы из прилежащих слоев цитоплазмы (рис. 11-29); в других случаях кортекс заметно тоньше и больше похож на двумерную структуру. В одни участках животных клеток небольшие пучки актиновых филаментов, отходящие от наружной стороны кортекса, заполняют выступы клеточной поверхности, тогда как в других актиновые филаменты втягивают мембрану внутрь.
Плазматическая мембрана настолько тесно связана с кортикальным актиновым слоем, что для некоторых целей лучше считать их единым функциональным образованием.
В большинстве животных клеток примерно половина всех молекул актина находится в неполимеризованной форме - в виде свободных мономеров или небольших комплексов с другими белками. Между этим пулом актина и актиновыми филаментами существует динамическое равновесие, что помогает осуществлять движения клеточной поверхности. В этом разделе мы расскажем о том, как актин-связывающие белки регулируют сборку актиновых филаментов, соединяют их в пучки или сети и определяют их расположение, длину и другие свойства.
11.2.1. Актин-связывающие белки «сшивают» актиновые филаменты в обширные сети [18]
Актиновые филаменты часто связаны между собой в жесткие трехмерные сети с помощью специальных сшивающих белков. Наиболее

Рис. 11-29. Актиновый кортекс на электронной микрофотографии тонкого среза лейкоцита. Хотя цитоплазму заполняют гранулы различного типа, в тонкий слой под самой плазматической мембраной (кортекс) они не попадают. Кортекс содержит сеть актиновых филаментов и связанных с ними белков, определяющих движения клеточной поверхности. (С любезного разрешения Dorothy Bainton.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
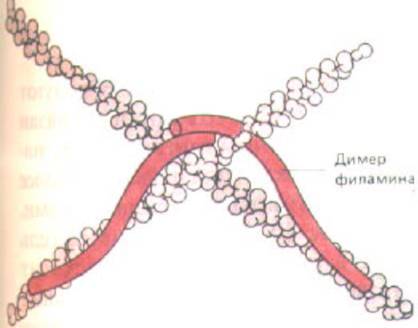
Рис. 11-30. Образуя гибкие сшивки между соседними актиновыми нитями, филамин создает из них трехмерную сеть, обладающую механическими свойствами геля. Каждый димер филамина, если его полностью выпрямить, имеет длину Около 160 нм.
распространенный из них - филамин; его длинная гибкая молекула состоит из двух одинаковых полипептидных цепей, соединенных «голова к голове», а участки связывания актиновых филаментов находятся на «хвостовых» концах (рис. 11-30). Во многих клетках белки такого типа составляют почти 1 % всего белка (примерно 1 димер на 50 мономеров актина).
Гели, образуемые in vitro актиновыми филаментами и сшивающими белками, обладают любопытными механическими свойствами: они сохраняют свою форму, если к ним приложить резкое короткое усилие, но легко деформируются под действием более слабой постоянной силы.
Предполагаемый молекулярный механизм, лежащий в основе такого поведения, характерного и для кортикальной цитоплазмы, показан на рис. 11-
31. По-видимому, именно такие актиновые сети позволяют клетке легко восстанавливать свою фирму за счет упругости после мелких толчков, но в то же время подвергаться значительным деформациям при длительном воздействии слабых сил.

Рис. 11-31. Механические свойства геля из актиновых филаментов, образованного с помощью белков, сшивающих актин. Гель противостоит резким деформациям (Б), так как сшивающие белки не успевают отделиться от актиновых филаментов. Сопротивление медленным деформациям гораздо слабее: сшивающим белкам хватает времени, чтобы диссоциировать и вновь связаться с актиновыми филаментами в других положениях. (По М. Sato, W.H. Schwartz, T.D. Pollard, Nature 325: 828-830, 1987.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
11.2.2. Гельзолин, активированный ионами Са2+, вызывает фрагментацию актиновых филаментов [19]
Экстракты, полученные из животных клеток многих типов, образуют гель, если к ним добавить АТР и прогреть до 37 °С. Этот процесс связан со взаимодействием актиновых филаментов и сшивающего белка, например филамина, однако поведение такого геля оказывается более сложным, чем у простой смеси филамина с актиновыми филаментами. Так, при увеличении концентрации Са2+ выше 10-7 М актиновый гель начинает разжижаться. Под микроскопом в участках, где происходит такой переход геля в золь, можно увидеть весьма энергичные локальные «течения». Очевидно, в экстрактах помимо актиновых филаментов и филамина должны присутствовать еще какие-то компоненты, благодаря которым ионы Са2+ вызывают превращение геля в золь и движение жидкости. Вероятно, именно эти компоненты ответственны за течение
цитоплазмы, наблюдаемое в некоторых крупных клетках, где оно необходимо для равномерного распределения метаболитов и других веществ. Эти внутриклеточные движения связаны, по-видимому, с быстрыми локальными изменениями в консистенции цитоплазмы - переходами гель/золь.
Из клеточных экстрактов удалось выделить несколько белков, которые разжижают актиновый гель в присутствии Са2 +. Из них лучше всего изучен гельзолин - компактный белок с мол. массой около 90 000. Связывая ионы Са2 +, гельзолин активируется, разрывает актиновные филаменты и образует «шапки» на появляющихся при этом плюс-концах филаментов, что ведет к разрушению сети из сшитых актиновых нитей.
Сходные белки содержатся в кортексе многих клеток позвоночных. фрагмонтирующие белки активируются при таких концентрациях Са2+ (около 10-6 М), которые создаются в цитозоле лишь на короткое время; как полагают, они служат посредниками в реакциях клеточного кортекса на внешние сигналы. Например, когда фагоцитирующий лейкоцит вступает в контакт с микроорганизмом, сеть актиновых филаментов в этом участке кортекса распадается, что позволяет поверхностному слою цитоплазмы окружить и поглотить микробную клетку. К механизмам, лежащим в основе таких движений, мы вернемся несколько позже.
11.2.3. Движение цитоплазмы может осуществляться с участием миозина [20]
В искусственных смесях из актиновых филаментов, филамина и гельзолина наблюдаются Са2 +-зависимые переходы геля в золь и обратно, однако к сокращению эти смеси не способны и в них не возникают такие потоки, как в богатых актином гелях, получаемых из клеток.
Судя по всему, для этого необходим миозин: неочищенные актиновые гели, из которых миозин избирательно экстрагирован, теряют сократимосгь и способность создавать течения. Поэтому можно предполагать, что источником силы для таких движений служит какое-то взаимодействие между актином и миозином.
Поскольку в исходном экстракте актиновые филаменты, видимо, образуют неупорядоченную трехмерную сеть, возникает вопрос: как могут актин и миозин производить согласованные движения? Актиновые филаменты, как мы знаем, обладают отчетливой полярностью, и миозиновые головки могут связываться с ними и скользить вдоль них только при правильной ориентации относительно этой полярности, Небольшие биполярные комплексы молекул немышечного миозина (см. рис. 11-26) могли бы до некоторой степени «упорядочивать» актиновые филаменты в растворе, просто подтягивая одну их группу относительно
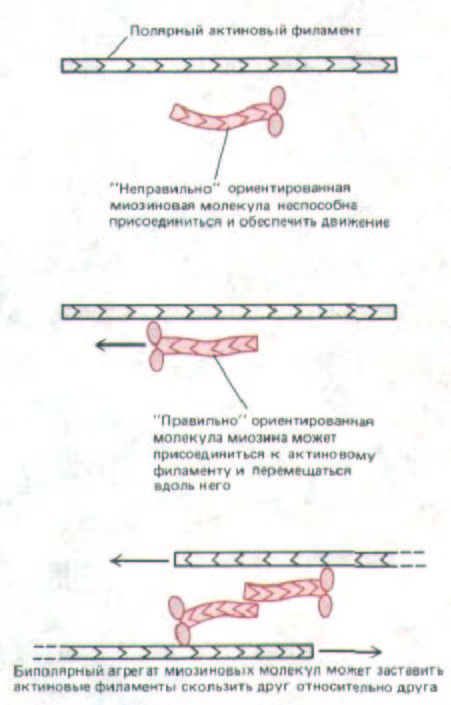
Рис. 11-32. Биполярные агрегаты молекул немышечного миозина (см. рис. 11-26) вызывают скольжение двух актиновых филаментов противоположной полярности (как и в мышце). Этим способом миозин может вызывать сокращение даже в сети из случайно ориентированных актиновых нитей.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
другой, даже если эти миозиновые комплексы и актиновые филаменты вначале не были хорошо ориентированы (рис. 11-32).
11.2.4. Цитоплазм этические потоки в гигантских клетках водорослей создаются при участии актина и миозина [21]
Растительные клетки могут достигать гораздо больших размеров, чем животные клетки, так как они обладают жесткой клеточной стенкой и содержат обширную центральную вакуоль (см. гл. 20, разд. 20.4.9). Диффузия при таких расстояниях недостаточно эффективна, поэтому очень крупным клеткам для перемешивания цитоплазмы нужны мощные цитоплазматические потоки. Гигантские многоядерные клетки зеленых водорослей Chara и Nitella достигают в длину 2-5 см, и белковой молекуле потребовались бы недели для диффузии от одного конца клетки до другого. Неудивительно, что у таких организмов мы находим самые яркие примеры цитоплазматических потоков. Непрерывный узкий поток цитоплазмы движется вдоль клетки в виде бесконечной спиральной ленты, обходя огромную центральную вакуоль (рис. 11-33, А). Этот поток увлекает с собой внутренние мембранные структуры, митохондрии и ядра со скоростью до 75 мкм/с.
Система, создающая потоки в таких клетках, находится между движущимся слоем цитоплазмы и неподвижным монослоем хлоропластов, лежащих под самой плазматической мембраной (рис. 11-33, Б), На электронных микрофотографиях в этой промежуточной области видны большие пучки актиновых филаментов с одинаковой полярностью. Эта полярность такова, что направленное движение вдоль них молекул миозина (от минус-конца к плюс-концу) совпадает с направлением наблюдаемых потоков цитоплазмы. Более того, можно «вскрыть» гигантскую клетку Nitella
так, чтобы обнажились актиновые пучки на поверхности слоя хлоропластов; если теперь добавить к препарату шарики латекса, покрытые миозином, то эти шарики в присутствии АТР будут двигаться по актиновой сети, причем движение их окажется очень похожим на перемещение органелл в интактной клетке. Таким образом, весьма вероятно, что цитоплазматические потоки создаются в клетке при участии миозина.
Для такого движения цитоплазмы, как у Nitella, биполярные миозиновые филаменты не нужны - ведь здесь происходит не сокращение, а непрерывное однонаправленное перемещение. Помимо немышечного миозина, организованного в филаменты (см. рис. 11-26), многие клетки содержат относительно небольшие молекулы так называемых мини-миозинов. Эти молекулы впервые были экстрагированы из крупных амеб

Рис. 11-33. Схема токов цитоплазмы в гигантской клетке водоросли Nitella. А. Путь движения цитоплазмы в цилиндрической клетке. Для простоты диаметр клетки относительно ее длины преувеличен. Б. Продольный разрез участка такой клетки; показана организация неподвижных и движущихся слоев цитоплазмы. В неподвижном кортикальном слое лежат хлоропласты, которые связаны с подлежащими пучками актиновых филаментов; под этими пучками расположен движущийся слой цитоплазмы, в нем находятся ядра, митохондрии к другие органеллы. На самом деле относительные размеры вакуоли гораздо больше, чем на рисунке.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
(Acanthamoeba); они состоят из единственной глобулярной головки с которой гибким хвостом, который, вместо того чтобы образовать спираль с таким же хвостом другой молекулы, связывается с мембранами-непосредственно или через другой белок. Очищенные мини-миозины in vitro присоединяются к мембранным органеллам и могут перемещать их вдоль ориентированных пучков актиновых филаментов, По-видимому, именно так осуществляется активный транспорт многих органелл в клетках.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 2310; Нарушение авторских прав?; Мы поможем в написании вашей работы!