
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронные структуры атомов элементов малых периодов
|
|
|
|
1-й период включает два s -элемента – водород и гелий. Электронные конфигурации их атомов: +1Н 1s1 и +2Не 1s2. Внутри 1-го периода водород обозначен дважды, т. е. его можно, с одной стороны, рассматривать как аналог щелочных металлов (может отдать электрон), а с другой – как аналог галогенов (может принять один электрон).
2-й период включает восемь элементов: два элемента s -типа и шесть р -типа. Этот период (как и все последующие) начинается щелочным металлом – литием +3Li 1s22s1. Для атомов элементов 2-го периода второй энергетический уровень является внешним, поэтому этот электронный слой атомов заполняется от одного до восьми электронами. С атома бора начинает заполняться 2р-подуровень:
+5В 1s22s22p1. Ёмкость р -подуровня равна шести электронам, поэтому при последовательном заполнении электронами атомных орбиталей р -подуровня, во 2-м периоде (как и во всех последующих периодах) могут разместиться шесть элементов р -типа. С увеличением числа р -электронов на внешнем уровне быстро нарастают неметаллические свойства. 2-й период завершается инертным элементом неоном +10Ne 1s22s22p6.
3-й период, также как и 2-й, включает восемь элементов: два элемента s- типа и шесть р-типа. В третьем уровне может находиться восемнадцать электронов (N = 2 n 2 = 2× 32 = 18). Так как для атомов элементов этого периода третий энергетический уровень является внешним, то согласно принципу Паули здесь не может находиться более восьми электронов. Поэтому от Al до Ar происходит заполнение 3р -подуровня. В 3-м периоде, третий энергетический уровень максимально не заполнен (свободным остаётся 3d- подуровень). Поскольку атомы элементов 3-го периода по строению внутренних энергетических уровней повторяют конфигурацию инертного элемента 2-го периода неона Ne, то можно использовать следующую форму записи: натрий +11Na [Ne] 3s1, алюминий +13Al [Ne] 3s23p1 и так до конца данного периода.
|
|
|
Приведенные выше электронные конфигурации атомов элементов малых периодов соответствуют невозбужденному (нормальному) состоянию. Этому состоянию отвечает минимальная энергия. Состояние, характеризующееся более высокой энергией, чем энергия основного состояния, называется возбужденным состоянием данного атома. Переход атома из нормального в возбужденное состояние сопровождается поглощением некоторой энергии. При наличии свободных орбиталей в пределах данного уровня происходит переход электрона с одного подуровня на другой. Например:
С ¾¾¾® С*
sp2 ¾¾¾® sp3
 ¾¾¾®
¾¾¾® 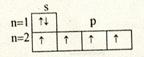
Неспаренных электронов становится четыре, следовательно, валентность атома углерода в возбужденном состоянии равна четырём.
|
|
|
|
|
Дата добавления: 2017-01-13; Просмотров: 2099; Нарушение авторских прав?; Мы поможем в написании вашей работы!