
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплоты образования веществ
|
|
|
|
Р е ш е н и е
Теплоты образования веществ
Р е ш е н и е
Теплоты сгорания веществ
| Вещество | C2H4 (газ) этилен | H2O (ж) | С2Н5ОН (ж) этиловый спирт |
| Количество молей, νi | |||
 , кДж/моль , кДж/моль
| –1410,97 | –1370,68 |
Так как реакция проходит при P = const, то стандартный тепловой эффект находим в виде изменения энтальпии по известным теплотам сгорания по следствию из закона Гесса (формула (1.18):
ΔНо298 = (–1410,97 + 0) – (–1370,68) = – 40,29 кДж.
Данная реакция является экзотермической (ΔНо298 < 0).
П р и м е р 1.4. Вычислить стандартный тепловой эффект следующей реакции при получении 10 кг железа:
FeO + CO = Fe + CO2
тв. газ тв. газ
Таблица 1.4
| Вещество | FeO (тв) | CO (газ) | Fe (тв) | СО2 (газ) |
| Количество молей, νi | ||||
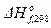 , кДж/моль , кДж/моль
| –264,85 | –110,53 | –393,51 |
Находим стандартный тепловой эффект по известным теплотам образования по следствию из закона Гесса (формула (1.17):
ΔНо298 = [0 + (–393,51)] – [(–264,85) + (–110,53)] = – 18,13 кДж.
Рассчитанное количество теплоты выделяется (ΔНо298 < 0) в соответствии с уравнением реакции при получении 1 моля железа.
Находим количество молей железа в 10 кг этого вещества:
n =g/M = 10 ·103/55,84 = 179,08 молей,
где g = 10 ·103 – количество железа, в г;
M = 55,84 – молярная (атомная) масса железа, в г/моль.
Находим количество теплоты, выделяющееся при получении 10 кг железа:
∑ ΔНо298 = 179,08 · (–18,13) = –3246,72 кДж.
П р и м е р 1.5. Вычислить стандартный тепловой эффект следующей реакции при получении 2 кг железа:
Fe2O3 + 3CO = 2Fe + 3CO2
тв. газ тв. газ
Таблица 1.5
| Вещество | Fe2O3 (тв) | CO (газ) | Fe (тв) | СО2 (газ) |
| Количество молей, νi | ||||
 , кДж/моль , кДж/моль
| –822,16 | –110,53 | –393,51 |
Р е ш е н и е
Находим стандартный тепловой эффект в виде изменения энтальпии по известным теплотам образования по формуле (1.17):
|
|
|
ΔНо298 = [2 · 0 + 3 · (–393,51)] – [(–822,16) + 3· (–110,53)] = –26,78 кДж.
Рассчитанное количество теплоты выделяется (ΔНо298 < 0) в соответствии с уравнением реакции при получении 2 молей железа. Следовательно, тепловой эффект при получении 1 моля железа составит:
(– 26,78): 2 = – 13,39 кДж
Находим количество молей железа в 2 кг железа:
n = g /M = 2 ·103/55,84 = 35,82 молей,
где g = 2 ·103 – количество железа, в г;
M = 55,84 – молярная (атомная) масса железа, в г/моль.
Находим количество теплоты, выделяющееся при получении 2 кг железа:
∑ ΔНо298 = 35,82 · (– 13,39) = – 479,63 кДж.
1.4.2. Расчет тепловых эффектов химических реакций при нестандартной температуре с применением уравнения Кирхгофа
Зависимость теплового эффекта  химической реакции от температуры при P = const описывается уравнением Кирхгофа:
химической реакции от температуры при P = const описывается уравнением Кирхгофа:
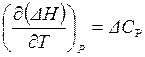 (дифференциальная форма); (1.19)
(дифференциальная форма); (1.19)
 (интегральная форма), (1.20)
(интегральная форма), (1.20)
где ΔСP – разность изобарных теплоемкостей продуктов реакции и исходных веществ с учетом количества молей реагентов (стехиометрических коэффициентов):
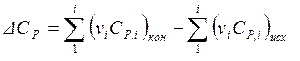 . (1.21)
. (1.21)
Из уравнения (1.19) следует, что характер зависимости ΔHT = f(T) определяется знаком ΔСP.
Если ΔСP > 0, то с увеличением температуры изменение энтальпии возрастает. При уменьшении теплоемкости за счет прохождения химической реакции (ΔСP < 0) ΔH убывает с ростом температуры. Для экзотермических реакций в этом случае величина ΔH становится все более отрицательной, то естьс возрастанием температуры наблюдается увеличение количества выделившейся теплоты при прохождении химической реакции. При изменении знака ΔСP с увеличением температуры на зависимости ΔHT = f(T) появляется экстремум.
Если разность (Т – Т1) невелика, можно принять ΔСP = const. Тогда
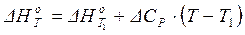 . (1.22)
. (1.22)
При точных расчетах необходимо учитывать температурную зависимость ΔСP = f(T). Так как для каждого вещества, участвующего в химической реакции, установлено уравнение в степенной форме вида (1.12) и (1.13), описывающее зависимость его теплоемкости от температуры, то разность теплоемкостей ΔСP в этом случае будет представлять собой уравнение, которое в общем виде записывается следующим образом:
|
|
|
ΔСP = Δa + Δb·T + Δc ·T2 + Δc΄/ T2, ( 1.23)
где Δa, Δb, Δc, Δc΄ – изменения коэффициентов при Т в соответствующих степенях, полученные при расчете ΔСP после приведения подобных.
Например, Δa рассчитывается по следующей формуле:
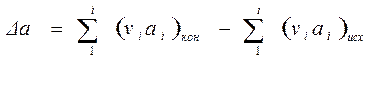 (1.24)
(1.24)
Аналогично рассчитываются значения Δb, Δc, Δc΄.
Если Т1 = 298, то уравнение Кирхгофа в интегральной форме (1.20) может быть применено для расчетов в следующей форме:
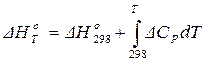 , (1.25)
, (1.25)
где ΔНо298 – стандартный тепловой эффект химической реакции.
После подстановки в выражение (1.25) уравнения ΔСP = f(T) (1.23) и его определенного интегрирования получим:
 . (1.26)
. (1.26)
Аналитическая зависимость теплового эффекта химической реакции от температуры ΔНоT = f(T) в окончательной форме может быть получена после подстановки в уравнение (1.26) найденных величин ΔНо298, Δa, Δb, Δc, Δc΄, выполнения действий и приведения подобных. Подставляя в полученное уравнение заданную нестандартную температуру, можно рассчитывать тепловой эффект химической реакции при данной температуре.
П р и м е р 1.6. Рассчитать тепловой эффект реакции разложения карбоната магния при температуре 700 К, используя для расчета ΔСP средние значения изобарных теплоемкостей в интервале температур 298÷700 К. Уравнение реакции:
MgCO3 = MgO + CO2
тв. тв. газ
Справочные данные представлены в табл. 1.6.
Таблица 1.6
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 1330; Нарушение авторских прав?; Мы поможем в написании вашей работы!