
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Схемы электрохимических цепей
|
|
|
|


Рис. 4.9. Цепь без переносаРис. 4.10. Цепь с переносом
(диффузионный потенциал не устранён)
y М1 | М2 | L | М2 Å y M1 | M2 | L2 L1 | M1 Å

Рис. 4.11. Цепь с переносом (диффузионный потенциал устранён)
y M1 | M2 | L2 || L1 | M1 Å
Концентрационные цепи - цепи, состоящие из электродов, на которых протекают одинаковые по природе электрохимические реакции. Электроды отличаются только активностями (концентрациями) участвующих в реакции компонентов. Источник электрической энергии - различные активности компонентов. Концентрационные цепи бывают без переноса и с переносом. Концентрационные цепи без переноса содержат один электролит.
Амальгамные цепи - состоят из двух одинаковых по своей природе амальгамных электродов с различными активностями металла в амальгамах (a 1 и а2):
y M(Hg) | MA | M(Hg) Å
электролит
а 1> а 2
Электродные реакции:
Å MZ+ + z e ® M(Hg) - восстановление
a 2
y M(Hg) - z e ® MZ+ - окисление
a 1
Электродный потенциал каждого амальгамного электрода:

Суммарный процесс в гальваническом элементе заключается в переходе металла из более концентрированной амальгамы в менее концентрированную и не является электрохимической реакцией:
М(Hg) ® М(Hg)
a 1 a 2
ЭДС амальгамной цепи
 ,
,
так как активность катионов металла в растворе  = const и
= const и
 ,
,
Газовые цепи состоят из двух одинаковых газовых электродов с различным давлением газа (Р):
y Pt | H2 | HCl | H2| Pt Å

Электродные реакции:
Å 2H+ + 2 e ® H2 - восстановление
y H2 – 2 e ® 2H+ - окисление
Электродный потенциал каждого газового электрода.
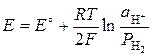
Суммарный процесс в гальваническом элементе состоит в выравнивании давлений газа. ЭДС газовой цепи:

Концентрационные цепи с переносом состоят из двух одинаковых электродов с различной активностью электролитов. Между двумя растворами электролита имеется граница соприкосновения (диафрагма, мембрана, солевой мост). Электроды могут быть обратимы по катиону и по аниону.
|
|
|
В катионных концентрационных цепях с переносом оба электрода обратимы по катиону:
y Ag | AgNO3 || AgNO3 | Ag Å - электроды I рода
a 1 < a 2
y Pt|H2 | HCl || HCl |H2|Pt Å - газовые электроды
a 1 < a 2
ЭДС цепи
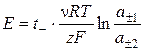 ,
,
где t– - число переноса аниона; n - число ионов, на которое диссоциирует одна молекула электролита; а ± - средняя ионная активность ионов.
В анионных концентрационных цепях с переносом оба электрода обратимы по аниону.
y Ag|AgCl | KCl || KCl | AgCl|Ag Å - электроды II рода
a 1 > a 2
y Pt|Cl2 | HCl || HCl |Cl2|Pt Å - газовые электроды
a 1 > a 2
ЭДС цепи
 ,
,
где t+ - число переноса катионов.
Химические цепи состоят из двух электродов, на которых протекают различные по природе электрохимические реакции. Они также могут быть без переноса и с переносом.
Химические цепи без переноса, в свою очередь, могут быть двух видов:
1) Содержат один электролит, но один электрод обратим по катиону, а другой по аниону:
газовый – газовый
y Pt |Cl2 | HCl |Cl2| Pt Å
электрод I рода – газовый
y Pt | Zn | ZnCl2 | Cl2| Pt Å
газовый – электрод II рода
y Pt| H2 | HCl |Hg2Cl2|Hg | Pt Å
амальгамный – электрод II рода
y Ag | Pt | K(Hg) | KCl | AgCl| Ag Å
электрод I рода – электрод II рода
(стандартный элемент Вестона)
y Pt | Cd(Hg) | CdSO4нас. | Hg2SO4 | Hg | Pt Å
ЭДС элемента Вестона:
 ,
,
где 
ЭДС элемента Вестона отличается высокой стабильностью и малым температурным коэффициентом:
Е = 1.01830 - 4,06×10-5×(t - 20), В
 ,
,
поэтому элемент Вестона используется в качестве стандартного элемента при потенциометрических измерениях;
2) Содержат один электролит, но оба электрода обратимы по аниону:
электрод II рода – газовый
y Pt | Hg| Hg2Cl2 | KCl | Cl2 (P = 1 атм)| Pt Å
ЭДС цепи: E = E0 = const - не зависит от концентрации электролита КС1.
Химические цепи с переносом содержат два электролита, которые контактируют между собой через диафрагму, мембрану или солевой мост:
|
|
|
электрод I рода – электрод II рода
y Pt | Ni | NiSO4 || KCl | Hg2Cl2ïHg | Pt Å
электрод I рода – электрод Red-Ox
y Pt | Cd | CdSO4 || Fe3+,Fe2+ | Pt Å
электрод Red-Ox – электрод Red-Ox
y Pt | Sn2+,Sn4+ || Fe3+,Fe2+ | Pt Å
электрод I рода – электрод I рода
(элемент Якоби-Даниэля)
y Cu | Zn | ZnSO4 || CuSO4 | Cu Å
4.3.2. Методика электрохимических измерений
Измерения ЭДС следует проводить в равновесных условиях, т.е. при отсутствии тока в цепи. Это достигается при использовании метода компенсации (рис. 4.9), в котором разность потенциалов (ЭДС) на концах цепи компенсируется выверенной по эталону разностью потенциалов от внешнего источника тока.

Рис. 4.9. Электрическая схема измерения ЭДС:
А – внешний источник тока (аккумулятор); Р - реохорд (потенциометр); Г – гальванометр (нуль-прибор); Еэт – эталонный элемент (Вестона); Ех – цепь с неизвестной ЭДС
ЭДС исследуемого гальванического элемента рассчитывается по формуле:
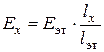 ,
,
где Е эт– ЭДС элемента Вестона; lх, l эт– показания реохорда.
Современные измерительные приборы обладают высоким входным сопротивлением (R > 109 Ом) и способны непосредственно измерять ЭДС гальванических элементов при отсутствии тока во внешней цепи.
Потенциометрия – измерение ЭДС электрохимических цепей для определения физико-химических характеристик растворов и химических реакций. Потенциометрическим методом могут быть определены:
1) Изменения термодинамических функций химических реакций. ЭДС электрохимической цепи измеряют при различной температуре, и (графически или аналитически) определяют температурный коэффициент ЭДС:
 в координатах Е = f(T).
в координатах Е = f(T).
Изменения термодинамических функций химической реакции, протекающей в гальваническом элементе, рассчитывают по формулам:
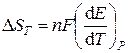


Для реакций, протекающих в конденсированной фазе


2) Константы равновесия химических реакций
 ,
,
откуда
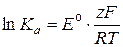 ,
,
где Кa - константа равновесия химической реакции;  - стандартная ЭДС электрохимической цепи; n - число электронов, участвующих в суммарной реакции.
- стандартная ЭДС электрохимической цепи; n - число электронов, участвующих в суммарной реакции.
3) Числа переносов ионов (по ЭДС концентрационных цепей с переносом)

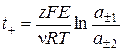
t + + t – = 1
4) Произведения растворимости (L) малорастворимых соединений:
|
|
|
 ,
,
где 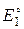 - стандартный потенциал электрода I рода, обратимого покатиону малорастворимого соединения;
- стандартный потенциал электрода I рода, обратимого покатиону малорастворимого соединения;  - стандартный потенциал электрода II рода, обратимого по аниону малорастворимого соединения
- стандартный потенциал электрода II рода, обратимого по аниону малорастворимого соединения
5) рН растворов. При измерении рН растворов электрохимические цепи должны состоятьиз индикаторных электродов (потенциалы которых зависят от рН) и электродов сравнения. Индикаторные электроды выбираются в соответствии с химической реакцией (водородный, хингидронный, стеклянный). Электроды сравнения предпочтительно использовать те, которые исключают диффузионный скачок потенциала (каломельный, хлорсеребряный).
6) Стандартные потенциалы, активность и коэффициенты активности электролитов. Для этих целей используются электрохимические цепи с одним электролитом (без переноса), электроды которых обратимы относительно катиона и аниона электролита.
Пример:
y Ag | PtïH2 | HCl |AgCl÷Ag Å
Суммарная реакция в цепи без переноса:
 Н2 + AgCl = Ag + H + + Cl-
Н2 + AgCl = Ag + H + + Cl-
ЭДС цепи без переноса:
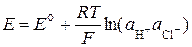 ,
,
где  .
.
Активность ионов можно выразить через моляльность т и средний ионный коэффициент активности g± для НСl:


тогда

или

По теории Дебая–Хюккеля для разбавленных растворов электролитов типа I-I

Поэтому
 ,
,
где 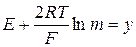 .
.
Величина у - функция моляльности раствора, которую рассчитывают по экспериментальным значениям ЭДС (Е) для растворов НС1 различных концентраций. По полученным данным строят график зависимости  – прямая линия (рис. 4.10).
– прямая линия (рис. 4.10).

Рис. 4.10. Зависимость функции y от концентрации раствора
При экстраполяции на ось ординат т® 0, g ± ® 1, lng ± ® 0 и
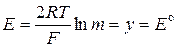
где E° - стандартный потенциал хлорсеребряного электрода.
Средний ионный коэффициент активности g± рассчитывают по известному значению стандартного потенциала E°.

Среднюю ионную активность а± рассчитывают по уравнению:

7) Активность (а 2) и коэффициент активности (g2) металла в амальгаме
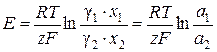 ,
,
где g1, а 1 - известные величины, х 1, х 2 – концентрации в молярных долях.
8) Точка эквивалентности при титровании.
Метод потенциометрического титрования позволяет анализировать зависимость электродного потенциала (или ЭДС) от состава раствора. Точка эквивалентности соответствует скачку электродного потенциала на кривой титрования (рис. 4.11).
|
|
|

Рис. 4.11. Кривые титрования: а) интегральная; б) дифференциальная:
V – объем титранта, т.э. – точка эквивалентности
Вид кривых титрования зависит от природы реагирующих веществ.
Работа 6. Измерение ЭДС элемента Якоби–Даниэля
Цель работы. Ознакомиться с методикой составления простейших гальванических элементов, измерения их ЭДС, а также электродных потенциалов относительно электрода сравнения Рассчитать электродные потенциалы и ЭДС элемента Якоби-Даниэля по уравнению Нернста в зависимости от различной активности электролита. Сравнить экспериментальные и табличные данные.
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 173; Нарушение авторских прав?; Мы поможем в написании вашей работы!