
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обработка результатов
|
|
|
|
Обработка результатов
1. Записывают схему исследуемого гальванического элемента.
2. Записывают уравнения электрохимических реакций, протекающих на электродах, и выражения электродных потенциалов в соответствии с уравнением Нернста.
3. Составляют суммарную реакцию, протекающую в гальваническом элементе.
4. Записывают уравнение Нернста для расчета ЭДС элемента.
5. Пользуясь справочными данными, определяют стандартную ЭДС исследуемого элемента.
6. Рассчитывают константу равновесия Ка химической реакции, протекающей в элементе, допустив, что Кa не зависит от температуры.
Часть 2. Определение потенциалов редокс-электродов
Экспериментально потенциал любого электрода может быть определен лишь по отношению к электроду сравнения, потенциал которого стабилен во времени и мало зависит от температуры. Поэтому для определения потенциала каждого электрода необходимо измерить ЭДС гальванического элемента, составленного из исследуемого окислительно-восстановительного электрода и хлорсеребряного электрода сравнения (Е = + 0,208 В).
Пользуясь справочником, определяют полярность каждого из исследуемых окислительно-восстановительных электродов по отношению к хлорсеребряному электроду сравнения.
Собирают электрическую схему (рис. 4.13) и включают измерительный прибор. При установившемся показании прибора результат заносят в табл. 4.9.
Таблица 4.9
t =____°С
| Гальванический элемент | Е, В | Е эксп., В | Е теор., В | % расхождения результатов |
Промывают солевой мост водопроводной, затем дистиллированной водой и сушат фильтровальной бумагой.
|
|
|
Для каждого гальванического элемента:
1. Приводят условную запись элемента.
2. Определяют значения электродных потенциалов на основании данных об ЭДС: Е = Е+ - Е–
3. Записывают уравнения электрохимических реакций, протекающих на электродах, и выражения потенциалов электродов в соответствии с уравнением Нернста.
4. Рассчитывают ионную силу растворов I с учётом разбавления при смешении электролитов. В тех случаях, когда неизвестна концентрация среды (кислоты, щёлочи), ионную силу принимают равной нулю.
5. Рассчитывают коэффициенты активности (gi) и активность (a i) потенциалопределяющих ионов, используя уравнение Дебая–Хюккеля (предельный закон):
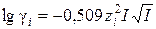 ,
,
где z i – заряд иона, 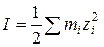 - ионная сила раствора, mi – моляльность ионов.
- ионная сила раствора, mi – моляльность ионов.
6. По уравнению Нернста рассчитывают потенциалы исследуемых окислительно-восстановительных электродов и сравнивают с экспериментальными значениями. Объясняют причину расхождения результатов.
7. Записывают суммарную реакцию, протекающую в каждом гальваническом элементе.
8. Записывают уравнения Нернста для расчета ЭДС каждого элемента.
Часть 3. Изучение влияния добавок веществ на потенциалы
окислительно-восстановительных электродов
Потенциалы окислительно-восстановительных электродов зависят, в первую очередь, от соотношения активностей (концентраций) потенциалопределяющих ионов в растворе. Увеличение концентрации окисленной формы (или уменьшение концентрации восстановленной формы) приводит к возрастанию потенциала электрода. Вместе с тем, ионы (вещества), не участвующие в электродных реакциях (индифферентные), изменяют ионную силу раствора, а, следовательно, и коэффициент активности и активность потенциалопределяющих ионов. Это опять же приводит к изменению потенциала электрода. Те вещества, которые вступают в химическое взаимодействие с потенциалопределяющими ионами, также влияют на потенциалы электродов.
|
|
|
Для оценки влияния различных веществ на потенциалы электродов составляются гальванические элементы, содержащие электрод сравнения.
Добавляют вещества в растворы электролитов только малыми порциями при непрерывном перемешивании раствора и в определённой последовательности. Измерения ЭДС проводят только при установившемся её значении.
В данной работе рекомендуется использовать добавки веществ:
К электроду № 1
– H2SO4 концентрированную (по каплям);
– СН3СООNа кристаллический (по 0,1 - 0,2 г) до окрашивания раствора в красный цвет;
– (NH4)2(COO)2 кристаллический (по 0,1 - 0,2 г) до обесцвечивания раствора и выпадения желтого осадка.
К электроду № 2
– Fe2(SO4)3 0,001 М раствор (по каплям) до образования темно-синего осадка.
К электроду № 3
– H2SO4 концентрированную (по каплям) до постоянства значений ЭДС.
– Н2O2 30%-й раствор (по каплям) до окрашивания раствора в красный цвет.
– HNO3 концентрированную (по каплям) до обесцвечивания раствора.
К электродам № 4, 5, 6, 7
– H2SO4 концентрированную (по каплям) до постоянства значений ЭДС.
Постройте график зависимости потенциал электрода - число капель кислоты.
На основании полученных данных сделайте выводы о химизме процессов, происходящих в окислительно-восстановительной системе при добавлении веществ и изменении активности потенциалопределяющих ионов.
Работа 4.8. Определение стандартного потенциала
окислительно-восстановительного электрода
Цель работы
– составить гальванический элемент, включающий в себя исследуемый окислительно-восстановительный электрод и электрод сравнения;
– измерить ЭДС составленного элемента в зависимости от соотношения активностей (концентраций) окисленной и восстановленной форм в растворе;
– определить значение стандартного потенциала окислительно-восстановительного электрода;
– исследовать влияние комплексообразующих веществ на потенциал редокс-электрода.
Последовательность выполнения работы. В работе рекомендуется использовать следующие электроды:
Электрод № 1. Fe3+, Fе2+ | Pt.
Для приготовления окислительно-восстановительной системы необходимо смешать:
– 0,1 М раствор FeSO4 и 0,1 М раствор Fe2(SO4)3, приготовленныена 0,1 н серной кислоте при соотношении окисленной и восстановленной форм: 9:1; 8:2; 7:3; 6:4; 5:5; 4:6; 3:7; 2:8; 1:9. Общий объём электролита – 10 см3.
|
|
|
Электрод № 2. Fe3+, Fe2+ | Pt.
Для приготовления окислительно-восстановительной системы необходимо смешать:
– 0,1 н. раствор FeCl2 и 0,1 н раствор FeCl3, приготовленные на 0,1 н соляной кислоте при соотношении окисленной и восстановленной форм: 9:1; 8,2; 7:3; 6:4; 5:5; 4:6; 3:7; 2:8; 1:9. Общий объём электролита – 10 см3.
Электрод № 3. Fe(CN)63–, Fe(СN)64– | Pt.
Для приготовления окислительно-восстановительной системы необходимо смешать
– 0,1 н раствор K3Fe(CN)6 и 0,1 н раствор K4Fe(CN)6 при соотношении окисленной и восстановленной форм: 9:1; 8:2; 7:3; 6:4; 5:5; 4:6; 3:7; 2:8; 1:9. Общий объём электролита – 10 см3.
Часть 1. Определение стандартного потенциала окислительно-восстановительного электрода
Солевой мост заполняют насыщенным раствором хлорида калия, плотно закрывают с обоих концов пробками из фильтровальной бумаги. В конических колбах приготавливают 9 окислительно-восстановительных систем с различным содержанием окисленной и восстановленной форм. Платиновый электрод выдерживают 5 мин в концентрированной азотной кислоте, промывают водопроводной, затем дистиллированной водой, сушат фильтровальной бумагой. Промывание, осушку электрода и солевого моста необходимо проводить всякий раз перед погружением в другой раствор.
Определяют полярность клемм измерительного прибора по стандартному элементу Вестона. Пользуясь справочником, определяют полярность исследуемого электрода по отношению к хлорид-серебряному электроду сравнения (Е = + 0,208 В). Собирают электрическую схему (рис. 4.13) и включают измерительный прибор. При установившемся показании прибора результат заносят в таблицу 4.10.
Таблица 4.10
t =____°С
| Соотношение форм oх/red | Е, В | Е, В | 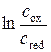
| Е°, В | I | gox | gred | 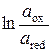
| Е°, В |
| 9:1 8:2 7:3 6:4 5:5 4:6 3:7 2:8 1:9 |
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 58; Нарушение авторских прав?; Мы поможем в написании вашей работы!