
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Интегральные методы 2 страница
|
|
|
|
Таблица 5.1
Температура опыта____оС; катализатор________; количество пероксида водорода_______
| № | Время измерения по часам | Время от начала реакции | Уровень жидкости в бюретке | Объём выделившегося газа, см3 | Скорость реакции | 
| 
| k | k ср |
| . . |
По опытным данным строят графики зависимости:
1) разности объёмов кислорода от времени  (на оси абсцисс откладывать время в минутах);
(на оси абсцисс откладывать время в минутах);
2) логарифма скорости реакции, определённой через различные промежутки времени от логарифма разности объёмов выделенного кислорода  ; скорость определяют по тангенсу угла наклона касательной к кривой
; скорость определяют по тангенсу угла наклона касательной к кривой  к оси времени;
к оси времени;
3) логарифма разности объемов кислорода от времени  .
.
Последние два графика используют для определения порядка реакции. Далее находят константу скорости реакции при помощи графика  и рассчитывают аналитически время полупревращения.
и рассчитывают аналитически время полупревращения.
Вычисляют константу скорости реакции, используя кинетическое уравнение реакции первого порядка в интегральной форме, где концентрации Н2О2 в начальный момент и в момент времени t заменены разностями объемов кислорода:
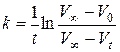 ,
,
Объем кислорода V ∞, выделившийся после разложения всего пероксида водорода (определяется как разность уровней в бюретке в момент, принятый за начало реакции, и после кипячения Н2О2 до полного разложения), V 0 – уровень жидкости в начальный момент определяется экстраполяцией на t = 0 прямой в координатах  .
.
Работа 5.2. Изучение кинетики реакции иодирования ацетона
|
СН3СОСН3 + I2 → СН3СОСН2I + Н+ + I–
В отсутствие катализатора – ионов водорода (в нейтральном разбавленном водном растворе) процесс протекает очень медленно, но при добавлении кислоты идёт автокаталитически. Механизм реакции можно схематично описать последовательностью двух стадий:
|
|
|
обратимая реакция енолизации ацетона:

взаимодействие йода с енольной формой:
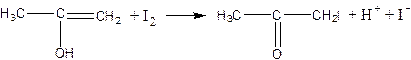
Первая реакция протекает медленно, а вторая – быстро и практически до конца. Поэтому общая скорость процесса определяется скоростью енолизации ацетона, которая пропорциональна концентрации ионов водорода и не зависит от концентрации йода. Таким образом, иодирование ацетона протекает в соответствии с кинетическим уравнением автокаталитической реакции второго порядка, которое записывается в следующем виде:
 , (5.40)
, (5.40)
где с 0,ац – начальная концентрация ацетона;  – начальная концентрация ионов водорода; сх – концентрация ацетона, подвергшегося превращению за время t; t – время от начала реакции до данного измерения.
– начальная концентрация ионов водорода; сх – концентрация ацетона, подвергшегося превращению за время t; t – время от начала реакции до данного измерения.
Ход реакции контролируется по анализу проб, периодически отбираемых из реакционной смеси.
Методика выполнения работы. В 250-миллилитровую мерную колбу наливают 25 см3 0,1 н. раствора I2 в 4 %-м растворе KI, добавляют заданный объём 1 н НС1 и доливают водой до объёма ниже метки примерно на 30–35 см3. В другую колбу наливают 25 см3 раствора ацетона с концентрацией 1 моль/л. Обе колбы, а также третью колбу с дистиллированной водой погружают в термостат, настроенный на определённую температуру. Спустя 15–20 мин раствор ацетона вливают в реакционную колбу, быстро доводят до метки дистиллированной водой, выдержанной в термостате, тщательно взбалтывают и помещают обратно в термостат. Момент вливания ацетона отмечают по часам как время начала реакции. Первую пробу (25 см3) отбирают приблизительно через 10 мин от начала реакции.
Отобранную пробу вливают в колбу для титрования, содержащую 25–30 см3 0,1 н NaHCO3 (количество NaHCO3 определяется объёмом кислоты –  ). Содержание йода определяют титрованием 0,01 н раствором гипосульфита натрия Na2S2O3 в присутствии крахмала (крахмал добавляют только в конце титрования, когда окраска раствора становится бледно-жёлтой). Всего отбирают 6–7 проб через каждые 10 мин. Расход гипосульфита на каждую последующую пробу должен изменяться на 1–3 см3. Во время отбора проб колбу из термостата не вынимают. После каждого отбора пробы колбу с реакционной смесью закрывают пробкой во избежание улетучивания ацетона.
). Содержание йода определяют титрованием 0,01 н раствором гипосульфита натрия Na2S2O3 в присутствии крахмала (крахмал добавляют только в конце титрования, когда окраска раствора становится бледно-жёлтой). Всего отбирают 6–7 проб через каждые 10 мин. Расход гипосульфита на каждую последующую пробу должен изменяться на 1–3 см3. Во время отбора проб колбу из термостата не вынимают. После каждого отбора пробы колбу с реакционной смесью закрывают пробкой во избежание улетучивания ацетона.
|
|
|
Результаты измерений записывают в табл. 5.2.
Таблица 5.2
Температура опыта______; объём 1н HCl_______
| Номер измерения | Время измерения (астроном.) | Время от начала реакции, мин | Объём 0.01 н. Na2S2O3, см3 | с0,ац, моль/л |  ,
моль/л ,
моль/л
| сх, моль/л | k |
| 3. . |
Концентрацию прореагировавшего ацетона сх определяют по уравнению:
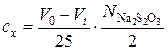 ,
,
где Vt – объем 0,01 н. Na2S2O3, израсходованный на титрование данной пробы, см3; V 0 – объем 0,01 н. Na2S2O3, который должен был быть израсходован на титрование в момент начала реакции, см3; 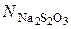 – нормальность раствора Na2S2O3.
– нормальность раствора Na2S2O3.
Значение V 0 практически определить не удаётся, так как от момента вливания ацетона до момента взятия первой пробы протекает значительное время. Так как порядок реакции по йоду равен нулю, то для нахождения V 0 строят график в координатах Vt – t и полученную прямую экстраполируют до t = 0 и по отсекаемому на оси ординат отрезку определяют V 0.
По уравнению (5.40) из значений с 0,ац,  , сх (при расчётах учитывают разбавление кислоты и ацетона) и t вычисляют константу скорости k. После этого определяют величину k ср графически по тангенсу угла наклона прямой в координатах
, сх (при расчётах учитывают разбавление кислоты и ацетона) и t вычисляют константу скорости k. После этого определяют величину k ср графически по тангенсу угла наклона прямой в координатах  , константа скорости при этом равна
, константа скорости при этом равна 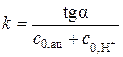 .
.
Вычисляют энергию активации реакции иодирования ацетона по уравнению (5.37) (значение k при другой температуре берут из справочника).
Работа 5.3. Изучение кинетики гидролиза тростникового сахара (сахарозы).
|
С12Н22О11 + Н2О → С6Н12О6 (глюкоза)+ С6Н12О6 (фруктоза)
Эта реакция бимолекулярная, однако, в большом избытке воды (слишком велика разница в молекулярных массах компонентов) изменением последней можно пренебречь и принять, что скорость реакции описывается кинетическим уравнением первого порядка: 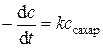 .
.
|
|
|
Скорость инверсии сахара в нейтральной среде очень мала. Присутствие ионов водорода как катализатора ускоряет реакцию и делает её доступной для наблюдения.
Тростниковый сахар и продукты его разложения принадлежат к числу оптически активных веществ, т.е. веществ, способных вращать плоскость поляризации проходящего через них поляризованного светового потока (светового потока, в котором колебания происходят в определённой плоскости). Оптическая активность таких веществ связана с наличием в их молекулах асимметричных (хиральных) атомов углерода. Угол поворота плоскости колебаний поляризованного луча называют углом вращения плоскости поляризации и обозначают α. Его величина прямо пропорциональна толщине слоя d и концентрации активного вещества с:
 (5.40)
(5.40)
Коэффициент пропорциональности а называют постоянной поляризации или удельным вращением, он зависит от природы вещества, длины волны, температуры и природы растворителя.
Удельное вращение равно углу вращения (в градусах) в слое раствора толщиной 1 дм, содержащего 1 г вещества в 1 см3 при 20 °С, при определенной длине волны (например, при длине волны жёлтой линии спектра паров натрия 589,6 нм). Зная угол вращения α, удельное вращение а (справочная величина) и толщину слоя раствора d, можно вычислить его концентрацию c.
Скорость инверсии тростникового сахара удобно изучать по изменению угла вращения плоскости поляризации исследуемого раствора во времени. Тростниковый сахар вращает плоскость поляризации вправо (α = 66.55o), а смесь продуктов инверсии – влево, так как глюкоза вращает вправо (α = 52.5o), а фруктоза – влево (α = –91.9o). Поэтому по мере протекания реакции угол вращения плоскости поляризации уменьшается, падает до нуля и затем становится отрицательным (инверсия вращения). Окончанию реакции соответствует предельное, неизменяющееся отрицательное значение угла вращения α∞.
Для измерения угла вращения плоскости поляризации используются специальные оптические приборы – поляриметры. Чаще всего применяются так называемые полутеневые поляриметры (рис. 5.12).
|
|
|
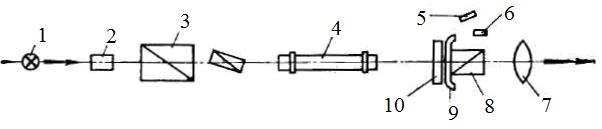 Рис. 5.12. Схема поляриметра:
Рис. 5.12. Схема поляриметра:
1 – источник света; 2 – светофильтр; 3 – поляризатор; 4 – поляриметрическая трубка; 5 – зеркало; 6 – лупа; 7 – окуляр; 8 – анализатор; 9 – указатель;10 – лимб
Поляризатор 3 состоит из двух призм Николя, причем меньшая по размерам призма прикрывает половину поля зрения. Плоскости поляризации этих призм находятся под некоторым углом друг к другу, поэтому поле зрения, рассматриваемое в окуляр 7, разделено на две части, отличающиеся по цвету и яркости освещения. Поляризатор неподвижен. Анализатор 8 (также призмы Николя) может вращаться вокруг оптической оси прибора. Вращением анализатора вокруг оси прибора можно достичь положения, при котором призмы Николя оказываются скрещенными и проходящий световой поток гасится. Если между поляризатором и анализатором расположен оптически активный раствор в трубке 4, то скрещенная призма уже не будет гасить проходящий световой поток, и для достижения темноты необходим дополнительный поворот анализатора на некоторый угол.
В полутеневом поляриметре положение плоскости поляризации светового потока определяется не по затемнению в окуляре прибора всего поля зрения, а по наступлению равной слабой освещённости (установка на полутень).
 Рис. 5.13. Поле зрения в окуляре полутеневого поляриметра
Рис. 5.13. Поле зрения в окуляре полутеневого поляриметра
В других положениях анализатора поле зрения в окуляре резко разделено на две части по освещённости или всё освещено ярко. Такое устройство обеспечивает более высокую точность измерений, так как чувствительность глаза к различию в освещенности значительно выше, чем к установлению полного затемнения. Если полутеневое положение найдено правильно (рис. 5.13, б), то малейший поворот анализатора вправо (рис. 5.13 а) или влево (рис. 5.13 в) нарушает равномерность освещения вплоть до резкого контраста в освещённости обеих половин поля зрения. При отсутствии поляриметрической трубки в желобке поляриметра полутеневое положение должно соответствовать нулю по шкале (нулевое положение поляриметра). Для получения параллельных пучков светового потока в приборе имеется система линз. Источником светового потока служит электрическая лампа. В белом световом потоке определению равной освещенности полей мешает разноцветность (вращательная дисперсия). Поэтому пользуются примерно монохроматическим световым потоком, употребляя светофильтр. Угол поворота анализатора отсчитывается по шкале (лимбу), движущейся при его вращении и неподвижному нониусу с точностью до десятых долей градуса (рис. 5.14). Отсчеты производятся следующим образом.
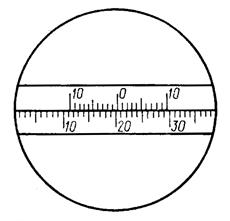
Рис. 5.14. Отсчет по шкале поляриметра
Число целых градусов определяют по последнему делению шкалы, которое оказывается слева от нуля (центральной метки) нониуса; десятые доли градуса определяют на правой части шкалы нониуса по делению, совпадающему в данном положении с каким-либо делением основной шкалы лимба. Так отсчитывают положительные углы вращения. Например, на рис. 5.14 угол вращения соответствует 20,3°. При вращении анализатора в противоположную сторону отсчитывают отрицательные углы вращения. Десятые доли градуса определяются по делениям в левой части шкалы нониуса. Для удобства наблюдений и измерений, связанных с освещенностью, поляриметр закрывают чёрным чехлом.
Последовательность выполнения работы. В колбу пипеткой или мерным цилиндром отбирают 10 см3 раствора сахарозы 20 мас. % и туда же вливают 10 см3 H2SO4 заданной концентрации. Раствор кислоты готовят разбавлением из 10 н H2SO4. Момент сливания кислоты с раствором сахара отмечают по часам как время начала реакции. Смесь тотчас же тщательно перемешивают и быстро вливают в хорошо вымытую поляриметрическую трубку, предварительно сполоснув её дистиллированной водой и два раза небольшим количеством исследуемого раствора. При наполнении трубки нужно следить за тем, чтобы в неё не попал воздух, так как пузырьки воздуха вызывают в поле зрения появление тёмных пятен. Чтобы быстро заполнить трубку без пузырьков воздуха, предварительно следует научиться заполнять её водой.
Трубку наполнить до краёв, чтобы жидкость образовала выпуклый мениск, затем осторожно сбоку надвинуть покровное стеклышко и навинтить кольцо, прижимающее стекло к торцу трубки. При этом проверить также, не подтекает ли трубка (не образуется ли пузырьков воздуха через некоторое время после заполнения). Наполненную трубку обтереть снаружи фильтровальной бумагой, обратив особое внимание на чистоту, сухость и прозрачность стекол, закрывающих торцы трубки, и поместить в желобок поляриметра в крайнее положение, ближайшее к окуляру.
Отсчёты проводят только после получения четкого изображения шкалы и поля зрения при вращении соответствующей муфты на зрительной трубке поляриметра. Все измерения проводят при комнатной температуре с обязательной записью её до и после опыта. Угол вращения определяют по полутеневому положению поляриметра через различные промежутки времени от начала реакции. Измерения осуществляют каждую минуту, пока угол вращения изменяется более чем на 1о, затем переходят к 2-, 3- и 5-минутным интервалам измерения до получения первого отрицательного значения. При этом записывают показание шкалы прибора (нижняя шкала на рис. 5.14) и соответствующее ему время по часам. Все определения проводят по возможности быстро.
После этого заливают в поляриметрическую трубку готовый раствор, в котором реакция уже прошла до конца и определяют предельный угол вращения α∞.
Результаты измерений сводят в табл. 5.4.
Таблица 5.4
Температура опыта_______; концентрация H2SO4________
| Номер измерения | Время измерения | Время от начала реакции | αt | α0-α∞ | αt-α∞ | Константа скорости инверсии k (c указанием размерности) | kср |
| . |
По результатам опыта вычисляют константу скорости реакции при данной температуре для каждого момента времени (кроме t = 0 и t = ∞) по уравнению реакции первого порядка, в которое вместо концентраций подставили пропорциональные им разности соответствующих углов вращения:
 , (5.41)
, (5.41)
где α0 – угол вращения в момент начала реакции; αt – угол вращения в момент времени t от начала реакции; α∞ – угол вращения, соответствующий концу реакции, t – время, прошедшее от начала реакции до момента данного измерения.
Все значения углов вращения подставляют в уравнение с соответствующими знаками: α∞ имеет отрицательный знак, следовательно, эту величину нужно суммировать с величиной α0. Угол α0, соответствующий моменту начала реакции, непосредственно измерить не удается, так как от начала реакции до первого измерения проходит значительное время, поэтому α0 определяют графически. Для этого экстраполируют прямую в координатах 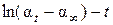 (рис. 5.15) до пересечения с осью ординат (t = 0). Из отсекаемого отрезка
(рис. 5.15) до пересечения с осью ординат (t = 0). Из отсекаемого отрезка  определяют угол вращения в момент начала реакции
определяют угол вращения в момент начала реакции  .
.

Рис. 5.15. К определению α0
Кроме этого, рассчитывают константу скорости k ср графически из тангенса угла наклона прямой в координатах 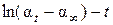 . Сравнивают значения констант скорости, найденных различными способами. Делают выводы по работе.
. Сравнивают значения констант скорости, найденных различными способами. Делают выводы по работе.
Работа 5.4. Изучение кинетики гидролиза уксусного ангидрида методом электрической проводимости
Гидролиз уксусного ангидрида протекает по уравнению
(СН3СО)2О + Н2О → 2СН3СООН
Реакция имеет второй порядок в ацетоне или в уксусной кислоте, однако в разбавленном водном растворе гидролиз идёт по реакции первого порядка и практически до конца. Молярная концентрация воды здесь значительно больше молярной концентрации уксусного ангидрида, поэтому убыль воды за счёт реакции мала и содержание её в растворе можно считать постоянным, а скорость реакции пропорциональной только концентрации уксусного ангидрида. Наиболее удобным способом изучения кинетики этой реакции является измерение электрической проводимости или сопротивления раствора, не требующее отбора проб для анализа. Электрическая проводимость системы значительно возрастает со временем вследствие образования уксусной кислоты.
Последовательность выполнения работы. Устанавливают термостат на заданную преподавателем температуру. В 100-миллилитровую мерную колбу помещают 12 см3 уксусного ангидрида и доводят объём раствора дистиллированной (предварительно термостатированной) водой до метки. В момент начала растворения уксусного ангидрида включают секундомер и не выключают его до конца опыта (до установления постоянного значения сопротивления раствора). Отмечают по секундомеру время начала и конца растворения (при прибавлении воды чётко видна граница раздела двух жидких слоёв, после взбалтывания наблюдается помутнение; момент исчезновения мути принимают за конец растворения). Среднее время считают за время начала реакции. Растворение проводят при энергичном перемешивании. Ячейку для измерения сопротивления (снабженную притертой крышкой) после двукратного ополаскивания исследуемым раствором заполняют этим же раствором. Электроды должны быть погружены в раствор на 0,5–1 см ниже уровня раствора.
В работе участвуют два студента. Один измеряет сопротивление, другой следит за секундомером и записывает показания. Измерения проводят тем чаще, чем выше температура опыта. Первые 3–5 измерений проводят через 0,5 мин, затем - через 1 мин до установления постоянного значения сопротивления. Результаты измерений записывают в табл. 5.5.
Таблица 5.5.
Температура опыта_______; концентрация раствора_______
| № | Время от начала реакции, мин | Rt, Ом | 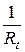
| 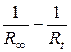
| 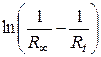
| k |
| . . |
При обработке результатов измерений следует учитывать, что исследуемая реакция является реакцией первого порядка. Пренебрегая неполной и меняющейся с концентрацией диссоциацией уксусной кислоты, в первом приближении можно принять, что увеличение электрической проводимости во времени пропорционально концентрации образующейся уксусной кислоты. Это грубое допущение, однако, при расчёте константы скорости происходит компенсация ошибок, и конечный результат получается удовлетворительным. Количество образовавшейся уксусной кислоты пропорционально количеству взятого уксусного ангидрида, поэтому с упомянутым допущением общее увеличение электрической проводимости в течение реакции можно считать пропорциональным начальной концентрации уксусного ангидрида.
Если обозначить электрическую проводимость раствора в момент начала реакции χ0, в данный момент χt и соответствующую последнему измерению χ∞ (когда она уже не меняется), то с 0 = const(χ∞– χ0):
(с 0 – с х) = const(χ∞– χ0) – const(χ t – χ0) = const(χ∞– χ t).
C учётом этого кинетическое уравнение для реакции первого порядка принимает вид:
 (5.42)
(5.42)
или, учтя далее, что 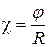 , где φ – константа прибора, получаем:
, где φ – константа прибора, получаем:
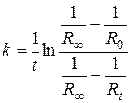 (5.43)
(5.43)
Сопротивление раствора в момент начала реакции R0 экспериментально не измеряется, так как от начала реакции до первого измерения проходит некоторое время. Поэтому R0 определяют экстраполяцией, для чего строят график  , откладывая время в минутах по оси абсцисс. Поскольку исследуемая реакция является реакцией первого порядка, экспериментальные данные в этих координатах должны укладываться на прямую. Экстраполируя полученную прямую до t = 0, находят
, откладывая время в минутах по оси абсцисс. Поскольку исследуемая реакция является реакцией первого порядка, экспериментальные данные в этих координатах должны укладываться на прямую. Экстраполируя полученную прямую до t = 0, находят 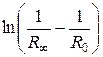 , а затем вычисляют R 0 (рис. 5.16).
, а затем вычисляют R 0 (рис. 5.16).

Рис. 5.16. К определению R 0
Вычислив константу скорости реакции для каждого момента времени, определяют среднее её значение и сравнивают с k ср, рассчитанной по времени полупревращения (для реакции первого порядка) и полученной графически (тангенс угла наклона прямой к оси t). По константам скорости при двух температурах (вторую константу взять из справочника) рассчитывают по следующим уравнениям значение предэкспоненциального множителя и энергию активации реакции по уравнениям (5.33) и (5.37). Делают выводы по работе.
Работа 5.5. Определение коэффициента диффузии паров
жидкости в воздухе методом увлечения
Цель работы. Определить коэффициент диффузии паров жидкости в воздухе методом увлечения.
Метод увлечения в определении коэффициента диффузии заключается в измерении скорости испарения жидкости из трубки диаметром 3-6 мм, у конца которой непрерывно пропускается поток газа, диффузию в который изучают.
Скорость газового потока должна быть такой, чтобы у среза трубки обеспечивалась нулевая концентрация паров исследуемого вещества. Схема установки для измерения коэффициента диффузии паров в воздухе приведена на рис. 5.17

Рис. 5.17. Схема установки для изучения кинетики испарения чистых жидкостей методом увлечения:
1а – колонка с CaCl2; 1б – колонка со щёлочью; 2 – буферная склянка; 3 – реометр; 4 – прибор для измерения; 5 - ультратермостат; 6 – буферная склянка с манометром; 7 – моностат
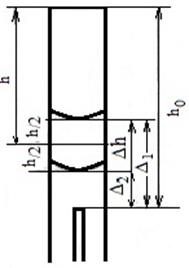 Последовательность выполнения работы. Измеряют катетомет-ром (до 0,1 мм) расстояние h 0 от среза трубки до конца имеющегося в трубке стеклянного столбика (рис. 5.18).
Последовательность выполнения работы. Измеряют катетомет-ром (до 0,1 мм) расстояние h 0 от среза трубки до конца имеющегося в трубке стеклянного столбика (рис. 5.18).
Рис. 5.18 Определение высоты диффузионного пространства
Наливают в тщательно вымытую сухую трубку для испарения необходимое количество исследуемой жидкости. Вставляют трубку с жидкостью в чистый и сухой прибор, помещенный в стеклянную рубашку. Закрывают прибор крышкой, предварительно слегка смазав шлиф вазелином. Настраивают термостат точно на нужную температуру. Включают насос и при помощи зажима устанавливают разность уровней жидкости в реометре, которая должна равняться скорости воздушного потока 300 см3/мин.
Выдерживают прибор 15 мин при заданной температуре, наводят катетометр при помощи окуляра и приступают к измерениям. Измеряют расстояние от верхней точки поверхности стеклянного столбика до нижней точки мениска. Отмечают время, когда было сделано измерение, атмосферное давление - по барометру и разницу между атмосферным давлением и давлением внутри прибора - по манометру.
Опыт ведут в течение 2 ч, повторяя измерение каждые 15 мин, их результаты заносят в табл. 5.6.
Таблица 5.6
Скорость испарения вещества______при температуре _____0С.
h 0, _______см; цена деления окуляра а, ____см; р ______ мм рт. ст., r ______ г/см3; молекулярная масса вещества_______
| Время, мин | Число делений по окуляру | р, мм. рт. ст. |
D1 ____________________деление_________см; h _____ см;
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 135; Нарушение авторских прав?; Мы поможем в написании вашей работы!