
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Векторні молекули
|
|
|
|
Уведення у клітину і стабільна підтримка генетичної інформації, що міститься у рекомбінантних молекулах ДНК, досягається за допомогою векторних молекул або векторів. Справа в тому, що при звичайному введенні ДНК, наприклад, у бактеріальну клітину вона, як правило, піддається атаці ферментів, які розкладають її на складові компоненти − нуклеотиди. В деяких випадках ДНК «виживає» у клітині, однак у процесі розподілу клітин вона не успадковується і втрачається. Для того, щоб рекомбінантна ДНК стала складовою частиною генетичного апарату клітини, вона повинна або вбудуватися в її геном (інтегруватися у хромосому) і реплікуватися за його рахунок, або бути здатною до автономної реплікації.
Векторами називають молекули ДНК, які здатні акцептувати (включати в себе) чужорідну ДНК і забезпечувати її реплікацію, експресію і (або) трансформацію (перенесення у інші організми). Таким чином, вектор дозволяє здійснити введення у клітину додаткової генетичної інформації. Як вектори використовують здебільшого плазміди, бактеріофаги, мобільні елементи, віруси тварин. У наш час створено значну кількість векторів, що розрізняються за профілем їхнього використання на декілька типів:
1. Вектори для клонування використовують для ампліфікації (збільшення кількості) шляхом реплікації фрагменту ДНК, що вбудований у такий вектор. Для цього найчастіше використовують бактеріальні плазміди і фати. Для клонування великих фрагментів геноми використовують вектори − штучні бактеріальні та дріжджові хромосоми (ВАС і YAC).
2. Вектори експресії. їх використовують для аналізу певних послідовностей генів і білкових продуктів, а також для вироблення певного білка. Існує значна кількість систем експресії, особливо для прокаріотичних організмів. Є також вектори для експресії генів у клітинах дріжджів, рослин і тварин. Вектори експресії для еукаріотів завжди містять промотор, здатний працювати у даному типі організму і сайт поліаденілірування (poly(A) − хвіст), що складається майже з 200 залишків аденозину. Наявність poly(A) − хвоста дозволяє відокремити матричну − мРНК від рибосомальної − рРНК і транспортної − тРНК, а також надає можливість приєднання олігомерів oligo(dT), що ініціюють синтез комплементарних ДНК-копій (кДНК) на підставі мРНК за допомогою рестриктази.
|
|
|
3. Вектори для трансформації. Використовують для введеннячужорідного фрагменту ДНК у геном реципієнта. Як правило,такі вектори містять специфічні послідовності, що сприяютьінтеграцію у геном.
Сучасні векторні системи часто бувають поліфункціональні і поєднують декілька функцій в одному векторі. У складі векторів є маркерний ген, який після проникнення вектора у клітину надає їй фенотип, що свідчить про наявність у клітині вектора. Тобто бажано щоб вектор мав селективну генетичну ознаку. Такими ознаками буває стійкість до антибіотиків, йонів важких металів та температури (рис. 21).
У цілому до векторних молекул висувають такі основні вимоги:
− вектор повинен мати унікальні сайти рестрикції для декількох рестриктаз (в кращому разі, по одному для кожної), що надає можливість вбудувати в нього фрагмент чужорідної ДНК;
− вектор повинен володіти певною ємністю і не виключати вбудованого фрагменту;
− вектор має бути репліконом, тобто здатним до реплікації, в певних клітинах за рахунок послідовності початку реплікації або власної, чи клітини-власника;
− вектор повинен містити послідовність маркерного гена, за допомогою якого можливо здійснити селекцію клітин з векторною конструкцією.
|
|
|
Для конструювання векторів у генній інженерії використовують хромосоми вірусів, фрагменти хромосом еукаріотичних клітин, а також невеликі молекули нуклеїнових кислот, здатних до автономної реплікації в бактеріальних і еукаріотичних клітинах − плазміди.
Перші ефективні вектори для клонування фрагментів чужорідної ДНК, що не втратили свого значення й понині, були отримані з використанням бактеріальних плазмід. Велика серія векторних плазмід, позначених символом pBR, створена на основі реплікона природної плазміди СоlЕІ, що надає клітинам Е. соli стійкість до колхіцину шляхом його об'єднання з генами стійкості до антибіотиків. Таким чином, бактеріальні клітини, що несуть подібні комбіновані плазміди, набували стійкість до відповідних антибіотиків і їх було легко відрізнити від безплазмідних клітин шляхом простого посіву на поживне середовище із антибіотиками. Генетична карта одного широко розповсюдженого вектора цієї серії − pBR322 зображена на рисунку 22, а. Така плазміда являє собою кільцеву ковалентну замкнену молекулу ДНК завдовжки 4363 п.н. Послідовність нуклеотидів pBR322 повністю вивчена. Плазміда містить гени стійкості до тетрацикліну (Тс) і ампіциліну (Ар). Обидва цих гени є селективними генетичними маркерами плазміди, тобто дозволяють проводити відбір бактеріальних клітин із плазмідою pBR322 за їхньою здатністю до росту на поживних середовищах у присутності тетрацикліну і (або) ампіциліну. Плазміда pBR322 також містить ділянку ДНК, що включає сайт початку реплікації (оri) і забезпечує її стабільну реплікацію в клітинах Е. соli. Характерною рисою плазміди pBR322, як і будь-якого сучасного вектора, є наявність у ній декількох унікальних сайтів рестрикції, що позначені на генетичній карті. Слід мати на увазі, що вбудовування в плазміду чужорідних фрагментів ДНК, що клонуються, по сайтах рестрикції, розташованих у генах Ар чи Тс (наприклад, Pst або ВатHI), буде порушувати цілісність цих генів і їхню функціональну активність. У результаті відбувається втрата бактеріальними клітинами, що містять рекомбінантні плазміди, стійкості до відповідних антибіотиків (рис. 23). За такою ознакою легко розрізняти бактеріальні клітини, які не містять плазміди (не ростуть за наявності ампіциліну й тетрацикліну), клітини із плазмідою, що не містять вставки ДНК, що клонується (ростуть за наявності обох антибіотиків), і клітини з рекомбінантними плазмідами (залежно від локалізації вставки можуть рости на середовищі тільки з одним із двох названих антибіотиків). Отже, наявність у векторних молекулах селективних маркерів різко підвищує ефективність клонування через можливість проведення швидкого відбору рекомбінантних плазмід на селективних поживних середовищах.
|
|
|
Крім генів стійкості до антибіотиків, як селективні маркери використовують й інші гени або їхні фрагменти. Зокрема, для цих цілей часто застосовуються гени різних ферментів, присутність яких у клітинах у складі плазміди виявляють за появою відповідної ферментативної активності. У векторах серії pUC, що часто використовуються, таким селективним маркером є 5'-кінцева частина гена  -галактозидази Е. соli - lacZ (рис. 22, б).
-галактозидази Е. соli - lacZ (рис. 22, б).  -галакгозидаза має здатність розщеплювати штучний субстрат Xgal з утворенням пофарбованого в блакитний колір продукту реакції. Вставка рекомбінантної ДНК у ці вектори розриває структурну частину гена
-галакгозидаза має здатність розщеплювати штучний субстрат Xgal з утворенням пофарбованого в блакитний колір продукту реакції. Вставка рекомбінантної ДНК у ці вектори розриває структурну частину гена  -галактозидази й інактивує його, у зв'язку з чим колонії бактерій із подібними рекомбінантними плазмідами, що виросли на поживному середовищі Xgal, не пофарбовані. Оскільки вектори серії pUC одночасно містять і ген стійкості до ампіциліну, відбір бактерій, що несуть рекомбінантні плазміди, можна здійснювати одночасно за цими двома маркерами.
-галактозидази й інактивує його, у зв'язку з чим колонії бактерій із подібними рекомбінантними плазмідами, що виросли на поживному середовищі Xgal, не пофарбовані. Оскільки вектори серії pUC одночасно містять і ген стійкості до ампіциліну, відбір бактерій, що несуть рекомбінантні плазміди, можна здійснювати одночасно за цими двома маркерами.
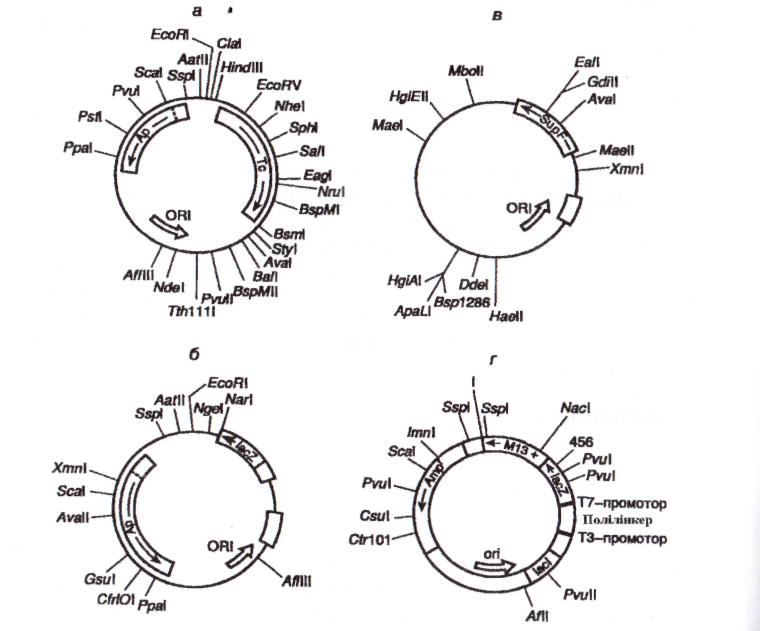
Рис. 22. Різноманітні вектори для клонування ДНК та їх рестрикційні карти.
Позначено розташування унікальних сайтів рестрикції та функціонально значимих генів: а − векторна плазміда pBR322; б − векторна плазміда, що здатна до експресії pUC18; в − векторна плазміда  , призначена для відбору рекомбінантних клонів; г − багатофункціональна векторна плазміда Bluescript.
, призначена для відбору рекомбінантних клонів; г − багатофункціональна векторна плазміда Bluescript.

Трансформантиростуть Трансформанти ростуть
за наявності Tet за наявністю Amp, але
за наявності Amp не за наявністю Tet
Рис. 23. Відбір рекомбінантних плазмід, що втратили стійкість до певного антибіотику
|
|
|
Однієї з вершин генно-інженерного мистецтва, що прекрасно ілюструє можливості генної інженерії, у цей час є поліфункціональні вектори серії Bluescript, отримані фірмою «Stratagem» (США) (див. рис. 22, г). Вектор BluescriptM13+ являє собою кільцеву ковалентну замкнуту молекулу ДРЇК завдовжки 3 т.п.н. Він містить у собі ген стійкості до ампіциліну Ampr, ген р-галактозидази lacZ, в N-кінцеву частину якого вбудований полілінкер, що містить унікальні сайти рестрикції для 21 рестриктази, промоторно-операторний сайт lacZ, а також ген l ас-репресора lac1. Крім того, вбудований у полілінкер фрагмент ДНК підпадає під контроль промоторно-операторної регуляторної послідовності гена lacZ і за наявності індуктора IPTG може бути експресований у клітинах Е. соli. На додаток до цього полілінкер у векторній плазміді містить на одному кінці промотор для Т7-, а на іншому − для ТЗ-РНК-полімераз, які орієнтовані назустріч одна одної. Це дозволяє транскрибувати кожний ланцюг клонованого фрагмента ДНК invitro за допомогою тієї або іншої РНК-полімерази й отримувати препаративні кількості мРНК або ж комплементарної їй антизначеннєвої РНК. Крім того, вектор Bluescript М13+ володіє міжгенною частиною (IG) фага f1, родинного фага М13. За наявності фага-помічника М13 відбувається переважне упакування одноланцюгової плазміди, що утворилася в результаті реплікації, у фагові часточки М13. Одноланцюгова ДНК BluescriptМ13+ після очищення може бути використана безпосередньо для секвенування клонованої ДНК або проведення сайт-специфічного мутагенезу. Вектори типу BluescriptM13+, здатні існувати або у вигляді плазміди, або в складі фагових часток ниткоподібних бактеріофагів, що називаються фагмідами.
За допомогою плазмідних векторів можна клонувати фрагменти ДНК завдовжки до 10 т.п.н. Однак, при створенні геномних бібліотек часто доводиться працювати із більшими фрагментами. Для цього розроблено вектори на основі бактеріофага  Е. соli.
Е. соli.
Після проникнення фага  у клітину Е. соli події можуть розвиватися за двома сценаріями. Якщо реалізується літичний цикл, то фаг починає інтенсивно розмножуватися й приблизно через 20 хв. клітина руйнується (лізує) із вивільненням до 100 нових фагових часток. При альтернативному варіанті розвитку подій фагова ДНК включається в хромосому Е. соli як профаг і реплікується в клітині разом із нормальними бактеріальними генами. Однак, за нестачі поживних речовин або інших несприятливих обставин інтегрована фагова ДНК вивільняється, і запускається літичний цикл розвитку. Розмір ДНК фага
у клітину Е. соli події можуть розвиватися за двома сценаріями. Якщо реалізується літичний цикл, то фаг починає інтенсивно розмножуватися й приблизно через 20 хв. клітина руйнується (лізує) із вивільненням до 100 нових фагових часток. При альтернативному варіанті розвитку подій фагова ДНК включається в хромосому Е. соli як профаг і реплікується в клітині разом із нормальними бактеріальними генами. Однак, за нестачі поживних речовин або інших несприятливих обставин інтегрована фагова ДНК вивільняється, і запускається літичний цикл розвитку. Розмір ДНК фага  становить близько 50 т.п.н., причому значна її частина (близько 20 т.п.н.) несуттєва для розмноження фага й відповідає за його вбудовування в ДНК господаря. У зв'язку з цим виникла ідея щодо заміни фрагментом іншої ДНК еквівалентного розміру. Рекомбінантна молекула, що створюється, буде реплікуватися у клітині як ДНК рекомбінантного фага
становить близько 50 т.п.н., причому значна її частина (близько 20 т.п.н.) несуттєва для розмноження фага й відповідає за його вбудовування в ДНК господаря. У зв'язку з цим виникла ідея щодо заміни фрагментом іншої ДНК еквівалентного розміру. Рекомбінантна молекула, що створюється, буде реплікуватися у клітині як ДНК рекомбінантного фага  , що став налітичний шлях розвитку.
, що став налітичний шлях розвитку.
Щоб зрозуміти, як функціонує векторна система на основі фага  , слід розглянути молекулярні аспекти літичного циклу розвитку. Інфекційна фагова частка має головку, в якій укладено щільно впаковану ДНК завдовжки майже 50 т.п.н., і відросток з тонкими білковими нитками (фібрилами), що відходять від нього. Збірка головки та відростка й упакування ДНК чітко скоординовані. ДНК фага
, слід розглянути молекулярні аспекти літичного циклу розвитку. Інфекційна фагова частка має головку, в якій укладено щільно впаковану ДНК завдовжки майже 50 т.п.н., і відросток з тонкими білковими нитками (фібрилами), що відходять від нього. Збірка головки та відростка й упакування ДНК чітко скоординовані. ДНК фага  − це лінійна дволанцюгова молекула завдовжки 50 т.п.н. з одноланцюговими 5'-«хвостами» з 12 нуклеотидів. їх називають «липкими» (cos) кінцями, оскільки вони взаємно комплементарні й можуть спаровуватися один з одним. Після того як фагова ДНК проходить через відросток і потрапляє в Е. соli, cos-кінці з'єднуються з утворенням кільцевої молекули. На ранньому етапі літичного циклу в результаті реплікації кільцевої молекули ДНК утворюється лінійна молекула, що складається з декількох сегментів завдовжки 50 т.п.н. (рис. 24, а). Кожний з таких сегментів упаковується в білкову головку, до останнього приєднується вже зібраний відросток і утворюється нова фагова часточка (рис. 24, б). При пакуванні молекули ДНК завдовжки менше 38 т.п.н. утворюється неінфекційна фагова часточка, а фрагменти завдовжки більше 52 т.п.н. не вміщаються в головку. Сегменти завдовжки 50 т.п.н. у лінійній молекулі ДНК розділені cos-сайтами, і саме по цих сайтах розрізається молекула, коли черговий сегмент заповнює головку. Розрізання здійснює фермент, що знаходиться біля входу в головку.
− це лінійна дволанцюгова молекула завдовжки 50 т.п.н. з одноланцюговими 5'-«хвостами» з 12 нуклеотидів. їх називають «липкими» (cos) кінцями, оскільки вони взаємно комплементарні й можуть спаровуватися один з одним. Після того як фагова ДНК проходить через відросток і потрапляє в Е. соli, cos-кінці з'єднуються з утворенням кільцевої молекули. На ранньому етапі літичного циклу в результаті реплікації кільцевої молекули ДНК утворюється лінійна молекула, що складається з декількох сегментів завдовжки 50 т.п.н. (рис. 24, а). Кожний з таких сегментів упаковується в білкову головку, до останнього приєднується вже зібраний відросток і утворюється нова фагова часточка (рис. 24, б). При пакуванні молекули ДНК завдовжки менше 38 т.п.н. утворюється неінфекційна фагова часточка, а фрагменти завдовжки більше 52 т.п.н. не вміщаються в головку. Сегменти завдовжки 50 т.п.н. у лінійній молекулі ДНК розділені cos-сайтами, і саме по цих сайтах розрізається молекула, коли черговий сегмент заповнює головку. Розрізання здійснює фермент, що знаходиться біля входу в головку.
У результаті досліджень з вивчення збирання фага X було розроблено систему пакування молекул ДНК invitro з утворенням інфекційних фагових часточок. Змішавши в пробірці очищені порожні головки, фагову ДНК і зібрані відростки, можна отримати інфекційні фагові часточки.
Один з множини  -векторів для клонування має два ВатНІ-сайти, що фланкірують ділянку завдовжки 20 т.п.н. За гідролізу очищеної фагової ДНК рестриктазою Ватн утворюються три фрагменти. Так називане ліве плече (частка L) містить генетичну інформацію про головку й відросток фага, праве плече (частка R) контролює реплікацію ДНК і лізисо, а середній сегмент має гени, що відповідають за процеси інтеграції й виключення (сегмент І/Е, від англ. integration/excision). Завдання дослідника полягає в тому, щоб замінити цю центральну ділянку нуклеотидної послідовності завдовжки до 20 т.п.н. потрібною ДНК. ДНК, що призначена дляклонування, теж розщеплюють за допомогою ВатHI і виділяють фрагменти розміром від 15 до 20 т.п.н. Обидва препарати − фагову й чужорідну ДНК − поєднують і додають ДНК-лігазу фага Т4, а потім −порожні головки і вже зібрані відростки.
-векторів для клонування має два ВатНІ-сайти, що фланкірують ділянку завдовжки 20 т.п.н. За гідролізу очищеної фагової ДНК рестриктазою Ватн утворюються три фрагменти. Так називане ліве плече (частка L) містить генетичну інформацію про головку й відросток фага, праве плече (частка R) контролює реплікацію ДНК і лізисо, а середній сегмент має гени, що відповідають за процеси інтеграції й виключення (сегмент І/Е, від англ. integration/excision). Завдання дослідника полягає в тому, щоб замінити цю центральну ділянку нуклеотидної послідовності завдовжки до 20 т.п.н. потрібною ДНК. ДНК, що призначена дляклонування, теж розщеплюють за допомогою ВатHI і виділяють фрагменти розміром від 15 до 20 т.п.н. Обидва препарати − фагову й чужорідну ДНК − поєднують і додають ДНК-лігазу фага Т4, а потім −порожні головки і вже зібрані відростки.
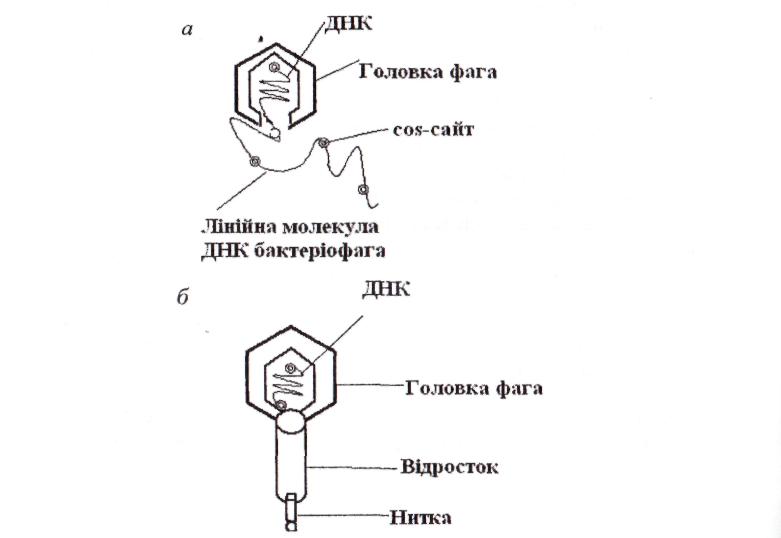
Рис. 24. Літичний шлях розвитку бактеріофага  :
:
а − під час реплікації кільцевої ДНК бактеріофага  утворюється лінійна молекула, що складається із повторюваних сегментів завдовжки 50 т.п.н.;
утворюється лінійна молекула, що складається із повторюваних сегментів завдовжки 50 т.п.н.;
б − фагова головка містить один такий сегмент, потім до головки приєднується зібраний відросток
Фрагменти ДНК завдовжки 50 т.п.н. упаковуються в головки, до них приєднуються відростки й утворюються інфекційні фагові часточки. Фрагменти більшого (>52 т.п.н.) або меншого (<38 т.п.н.) розміру впаковуватися не можуть.
Фагові вектори дозволяють клонувати фрагменти ДНК завдовжки 15...25 т.п.н. Однак, цього явно недостатньо, щоб клонувати багато генів тварин і рослин, довжина яких найчастіше перевищує 35...40 т.п.н. Необхідною місткістю володіють векторні молекули, названі космідами (рис. 25). Косміди являють собою невеликі плазміди, в які invitro введені cos-сайти ДНК фага X. Звідси походить назва всього типу даних векторів (cosmid). У ДНК нормальних фагових часток cos-сайти розташовані на кінцях молекул, що розділяють мономери фагової ДНК. У процесі пакування cos-сайти розпізнаються за компонентами ферментативної системи й за ними відбувається послідовне відділення (відрізання) упакованої у фагову часточку  -ДНК від іншої не упакованої ДНК.
-ДНК від іншої не упакованої ДНК.
Таким чином, наявність cos-сайтів у ДНК є, власне кажучи, єдиною необхідною умовою для упакування ДНК у фагові часточки. Це означає, що послідовність нуклеотидів  -ДНК, що розташована між двома cos-сайтами, містить у собі весь фаговий геном (35...45 т.п.н.), може бути заміщена invitro на аналогічний за довжиною (З8...52 т.п.н.) фрагмент чужорідної ДНК і ефективно впакована у фагові частки (така максимальна місткість головки фага). Природно, що така штучна фагова часточка виявляється нежиттєздатною.
-ДНК, що розташована між двома cos-сайтами, містить у собі весь фаговий геном (35...45 т.п.н.), може бути заміщена invitro на аналогічний за довжиною (З8...52 т.п.н.) фрагмент чужорідної ДНК і ефективно впакована у фагові частки (така максимальна місткість головки фага). Природно, що така штучна фагова часточка виявляється нежиттєздатною.
Однак, після адсорбції химерної фагової часточки на поверхні бактеріальної клітини укладена в ній ДНК проникає (уводиться фаговою часточкою) всередину бактерії й починає автономно реплікуватися як плазміда, розмір якої становить 30...40 т.п.н. Оскільки така плазміда (косміда) містить у своєму складі селективні маркери у вигляді генів стійкості до антибіотиків, її підтримують у бактеріальних клітинах шляхом вирощування бактерій на середовищі з відповідними антибіотиками. Незважаючи на те, що місткість космідних векгорів значно вища фагових, ефективність клонування в космідах нижча, хоча й досягає в ряді випадків 105...106 колоній на 1 мкг ДНК, що клонується. За такою ефективністю пакування потрібно всього 2...4 мкг цієї ДНК, для одержання повної клонотеки більшості еукаріотичних геномів.
Стадія пакування ДНК космід у фагові часточки використовується лише для полегшення процесу введення рекомбінантних ДНК великого розміру всередину бактеріальних клітин. Такий процес імітує проникнення фагової хромосоми в бактерії під час фагової інфекції. У випадку космід подібність між їхнім проникненням у бактеріальні клітини і фаговою інфекцією на цьому закінчується. Однак, подібність є більш глибокою у випадкувекторів, названих фазмідами. Фазміди − це векторні молекули ДНК, що містять у собі генетичні елементи плазмід і хромосом бактеріофагів. Вони можуть мати, місткість у відношенні до ДНК, що клонується, характерну для  -векторів, та існувати за певних умов у бактеріальних клітинах у вигляді плазміди або ж упаковуватися у фагові часточки invivo за зміни цих умов.
-векторів, та існувати за певних умов у бактеріальних клітинах у вигляді плазміди або ж упаковуватися у фагові часточки invivo за зміни цих умов.

Рис. 25. Космідний вектор і конструювання клонотеки геномної ДНК на його підставі
Хромосоми вищих організмів містять у своєму складі протяжні молекули ДНК. Наприклад, довжина ДНК однієї з типових хромосом людини становить 100...200 мільйонів пар основ (м.п.о.). Дослідження генів у хромосомах вищих рослин, тварин і людини потребувало створення векторів для клонування фрагментів ДНК завдовжки в кілька сотень тисяч пар основ. Цим завданням відповідає система, створена для клонування наддовгих молекул ДНК на основі штучно отриманої міні-хромосоми дріжджів YAC (yeastartificialchromosome). YAC – вектор являє собою кільцеву молекулу ДНК, що містить ряд генетичних елементів, які дозволяють їй існувати у позахромосомному стані в клітинах дріжджів (рис. 26).

Рис. 26. Схема клонування наддовгих молекул ДНК із застосуванням вектора YAC:
1 - перетворення ДНК вектора у лінійну форму за допомогою рестриктази ВатHI; 2 - розщеплення лінійної ДНК вектора рестриктазою ЕсоRI з утворенням «плечей»; 3 - введення у вектор EcoRI -фрагменту ДНК, що клонується
Вектор містить два селективних маркери TRP, що відновлюють здатність до росту ауксотрофних (ауксотрофна клітина − це клітина, що втратила здатність синтезувати певну речовину, існування без якої неможливе, але за наявністю у середовищі цієї речовини, життєздатність клітини поновлюється), по триптофану клітин дріжджів під час відсутності екзогенного триптофану. Крім цього, він володіє послідовностями нуклеотидів, необхідними для його реплікації в бактеріальних клітинах.
Рекомбінантними ДНК, що отримані на основі YAC-вектора, трансформують протопласти (клітини позбавлені оболонки) клітин дріжджів. Трансформанти, що утворилися, відбирають на селективному твердому поживному середовищі. У такому векторі вдавалося здійснювати клонування фрагментів ДНК завдовжки до 700 т.п.н.
При всіх своїх перевагах системи клонування, засновані на векторах родини YAC, мають ряд істотних недоліків. У рекомбінантних ДНК, що підтримані у таких системах, часто виникають внутрішні делеції. Крім того, за введення рекомбінантних ДНК у клітини дріжджів іноді має місце проникнення в одну клітину декількох молекул вектора із вставками.
У підсумку окремі клони дріжджових клітин можуть містити декілька не зчеплених одну з одною молекул рекомбінантних ДНК, а рекомбінація між ними взагалі може призводити до утворення химерних молекул. Усе це дуже ускладнює фізичне картирування генів у хромосомах об'єктів, що досліджуються. Для подолання такого роду труднощів були сконструйовані альтернативні векторні системи, серед яких найбільш популярними в цей час є ті, що засновані на штучних хромосомах бактерій -ВАС (bacterialartificialchromosome).
Сучасні BAC -вектори дозволяють клонувати фрагменти ДНК завдовжки до 300 т.п.н. і більше (рис. 27). Рекомбінантні молекули вводяться в клітини Е. соli за допомогою електропорації, причому ефективність утворення трансформантів у 10... 100 разів вища, ніж за звичайної трансформації сферопластів (клітини, оболонка яких зруйнована лише частково) дріжджів векторами родини YAC. Це дозволяє зменшити вихідну кількість ДНК, необхідну для конструювання репрезентативних клонотек генів.
Оскільки рекомбінантні BAC -вектори існують у бактеріальних клітинах у вигляді однієї копії, виключається спільне клонування водній клітині різних фрагментів ДНК і утворення химерних молекул, що досить істотно для фізичного картирування великих геномів.

Рис. 27. Вектор pBAC108L − представник родини BAC -векторів
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 316; Нарушение авторских прав?; Мы поможем в написании вашей работы!