
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 1. Расчет теплот физических и химических превращений
|
|
|
|
ДОДАТКИ
Додатки оформляються як продовження ІНДЗ на наступних його сторінках, розміщуючи їх у порядку появи посилань у тексті ІНДЗ.
Якщо додатки оформляються на наступних сторінках ІНДЗ, кожний такий додаток повинен починатися з нової сторінки. Додаток повинен мати заголовок, надрукований справа угорі малими літерами з першої великої літери симетрично відносно тексту сторінки.
Наприклад, “Додаток ___”, ____– всі літери української абетки, крім Г, Є, І, Ї, Й, О, Ч, Ь.
Додаток А, Додаток В.
Задача №1
Вещество А (табл.1) в количестве m г находится при T = 25 ºС и давлении p1 = 1,013 ·105 Па. Определить теплоту Q, работу A, изменение внутренней энергии DU и изменение энтальпии DH: а) при изотермическом расширении до объема V2 м3; б) при изобарном расширении до того же объема; в) при изохорном нагревании до достижения давления p2 Па; г) при адиабатическом сжатии до p 2 Па. Принять, что вещество А подчиняется законам идеальных газов. Истинную мольную теплоемкость вещества взять из справочника.
Таблица 1
| Вариант | А | m, г | V2, м3 | p2∙ 10–5, Па |
| Br2 | 0,5 | 1,30 | ||
| СО2 | 0,25 | 1,97 | ||
| N2 | 0,30 | 1,93 | ||
| Р4О10 | 0,12 | 1,95 | ||
| SО2 | 0,23 | 1,5 | ||
| Cl2 | 0,12 | 1,97 | ||
| BCl3 | 0,25 | 1,92 | ||
| BF3 | 0,10 | 1,40 | ||
| COCl2 | 0,28 | 1,99 | ||
| COS | 0,32 | 1,92 | ||
| O2 | 0,32 | 1,91 | ||
| NOCl | 0,40 | 1,96 | ||
| NO2 | 0,21 | 1,97 | ||
| N2O | 0,26 | 1,92 | ||
| N2O4 | 0,28 | 1,91 | ||
| N2O5 | 0,21 | 1,93 | ||
| PCl3 | 0,28 | 1,50 | ||
| PCl5 | 0,25 | 1,92 |
Продолжение таблицы1
| H2 | 0,20 | 1,96 | ||
| SO3 | 0,16 | 1,91 | ||
| SbCl3 | 0,18 | 1,90 | ||
| SiCl4 | 0,19 | 1,93 | ||
| SiCF4 | 0,24 | 1,91 | ||
| SiH4 | 0,32 | 1,97 | ||
| HJ | 0,36 | 1,60 | ||
| HF | 0,42 | 1,92 | ||
| HBr | 0,51 | 1,96 | ||
| HCl | 0,52 | 1,91 | ||
| HCN | 0,38 | 1,85 | ||
| ClO2 | 0,61 | 1,75 |
|
|
|
Решение:
Для двуокиси углерода CO2 в количестве 100 г, находящейся при температуре T = 0 ºС и давлении p = 1,013 ·105 Па, определим Q, A, DU и DH: а) при изотермическом расширении до объема 0,2 м3; б) при изобарном расширении до того же объема; в) при изохорном нагревании до достижения давления 2,026 ·105 Па; г) при адиабатическом сжатии до 2,026 ·105 Па.
Математическое выражение I-го закона термодинамики для процессов, связанных с бесконечно малыми изменениями состояния системы, имеет вид
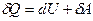 , (1)
, (1)
где Q – теплота; U – внутренняя энергия; A – работа.
Функции, которые однозначно определяют состояние системы, называют функциями состояния. Внутренняя энергия U, а также энтальпия H, которая выражается уравнением
 , (2)
, (2)
являются функциями состояния. Теплота Q и работа A служат формами передачи энергии и связаны с процессом, а не с состоянием системы, т.е. являются функциями процесса.
В двух частных случаях теплота и работа приобретают свойства функций состояния (закон Гесса):
 ; (V = const, T = const) (3)
; (V = const, T = const) (3)
 . (p = const, T = const) (4)
. (p = const, T = const) (4)
В интегральной форме математическое выражение I-го закона термодинамики имеет вид
 . (5)
. (5)
Для решения задачи примем, что CO2 подчиняется законам идеальных газов, а истинная мольная теплоемкость CO2 при постоянном давлении постоянна и равна 37,1 Дж/моль·К.
а) для изотермического расширения
∆U = 0 и ∆H = 0, следовательно Q = A.
Если из всех внешних сил на систему действует только внешнее давление p, то при переходе системы из состояния 1 в состояние 2 работу расширения можно вычислить по уравнению
 . (6)
. (6)
Для изотермического процесса
 . (7)
. (7)
Определим число молей CO2 по формуле
 . (8)
. (8)
Число молей CO2 в 100 г составляет n = 100/44 = 2,27 моль.
Первоначальный объем определяем из уравнения Клапейрона – Менделеева
|
|
|
 , (9)
, (9)
 = 2,27·8,314·273/1,013·105 = 0,0509 м3.
= 2,27·8,314·273/1,013·105 = 0,0509 м3.
Количество теплоты и работы определяем по уравнению (7)
Q = A = 2,3·2,27·8,314·273 lg (0,2/0,0509) = 7070 Дж = 7,07 кДж.
б) для изобарного процесса
 . (10)
. (10)
Отсюда Qp = ∆H = 2,27·37,1·273/0,0509 (0,2 – 0,0509) = 67400 Дж =
= 67,4 кДж.
Работа расширения газа в изобарных условиях
 , (11)
, (11)
A = 1,013·105 (0,2 – 0,0509) = 15000 Дж = 15,0 кДж.
Из уравнения (5)  = 67,4 – 15,0 = 52,4 кДж.
= 67,4 – 15,0 = 52,4 кДж.
в) для изохорного процесса
 . (12)
. (12)
Выражение для взаимосвязи мольной теплоемкости идеальных газов при постоянном давлении Сp и при постоянном объеме CV имеет вид
 . (13)
. (13)
Теплоемкость при постоянном объеме
CV = Cp – R = 37,1 – 8,31 = 28,8 Дж/моль·К.
QV = ∆U = 2,27·28,8·273/1,013·105 (2,026 ·105 – 1,013·105) = 17900 Дж = = 17,9 кДж.
Из уравнения (2) для изохорного процесса имеем:
 .
.
Отсюда
∆H = 17,9 + 0,0509 (2,026 – 1,013) · 105 = 23100 Дж = 23,1 кДж.
г) для адиабатического сжатия
Q = 0 и A = – ∆U
 , (14)
, (14)
где  = 37,1/28,8 = 1,29.
= 37,1/28,8 = 1,29.
 = – 970 Дж = – 2,97кДж.
= – 970 Дж = – 2,97кДж.
Из уравнения (2) для адиабатического процесса
 .
.
Выражая конечный объем V2 из уравнения адиабаты  , получим
, получим
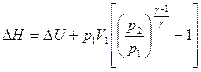 , (15)
, (15)
 = 3830 Дж = 3,83кДж.
= 3830 Дж = 3,83кДж.
Задача №2
Определите тепловой эффект реакции, приведенной в табл. 2, при T = 298 Ки р = 1,0133·105 Па:
а) по стандартным теплотам образования исходных и конечных веществ;
б) по стандартным теплотам сгорания исходных и конечных веществ.
Таблица 2
| Вариант | Реакция |

| |

| |

| |
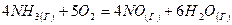
| |
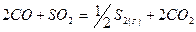
| |

| |
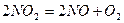
| |
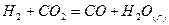
| |

| |
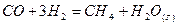
| |

| |
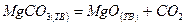
| |

| |
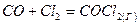
| |

| |

| |
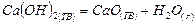
| |

| |

| |

| |

| |

| |
| Продолжение таблицы 2 | |
| Вариант | Реакция |

| |

| |

| |

| |

| |

| |

| |
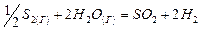
|
Решение:
Решение задачи рассмотрим на примере реакции синтеза аммиака:
 .
.
а) Согласно следствию из закона Гесса, тепловой эффект реакции при стандартных условиях равен разности сумм стандартных теплот образования продуктов и исходных веществ:
 , (16)
, (16)
где  – стехиометрические коэффициенты веществ в уравнении реакции.
– стехиометрические коэффициенты веществ в уравнении реакции.
Воспользуемся справочником физико-химических величин (табл.3):
Таблица 3
| Вещество |  , кДж/моль , кДж/моль
|
| N2 | |
| H2 | |
| NH3 | –45,94 |
 ,
,
 = 2·(–45,94) – (0 + 3·0) = –91,88 кДж.
= 2·(–45,94) – (0 + 3·0) = –91,88 кДж.
|
|
|
б) Для реакций, протекающих с участием органических веществ, тепловой эффект реакции при стандартных условиях можно определять и по стандартным теплотам сгорания как разность сумм стандартных теплот сгорания исходных веществ и продуктов реакции:
 . (17).
. (17).
в) При отсутствии данных о теплотах образования или сгорания веществ, участвующих в реакции, можно вычислить тепловой эффект реакции, используя для этого методы приближенного расчета тепловых эффектов, например, по энергиям химических связей. В этом методе расчета сначала предполагают разложение исходных простых веществ на атомы, а затем образование из них конечного газообразного соединения. Первый этап связан с затратой энергии на разрыв связей в исходных простых веществах, а второй – с выделением энергии образования новых связей. Поэтому тепловой эффект реакции может быть определен по уравнению
 , (18)
, (18)
где n – число связей данного вида; ε – энергия разрыва или образования связей; n * – число атомов твердых элементов; Qвозг – теплота возгонки твердого элемента..
Задача №3
Определите, насколько отличается тепловой эффектпри постоянном давлении  от теплового эффекта при постоянном объеме
от теплового эффекта при постоянном объеме 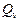 при T = 298 К дляреакции, приведенной в табл. 2.
при T = 298 К дляреакции, приведенной в табл. 2.
Решение:
Решение задачи рассмотрим на примере реакции синтеза аммиака:
 .
.
Из первого закона термодинамики (1) для случая, когда в системе не совершается других видов работы, кроме работы расширения,
 ;
;
 .
.
Изменение внутренней энергии и изменение энтальпии связаны формулами:
 , (19)
, (19)
или
 , (20)
, (20)
где Dn – изменение числа молей газообразных продуктов в ходе реакции.
Таким образом, соотношение ∆H и ∆U определяетсязнаком Dn.
Для реакции 
Dn = (2) – (1 + 3) = – 2;
Dn < 0, следовательно DH < DU.
Определим разницу ∆H – ∆U при T= 298 К:
∆H – ∆U = DnRT =
= (–2)·8,314 Дж/(моль·К)·298К = – 4955,14 Дж = – 4,96 кДж.
Задача №4
Определите стандартную теплоту образования соединения (табл. 4) из простых веществ, если известна его теплота сгорания при температуре Т =298 К и давлении р = 1,0133·105 Па. Принять, что продуктами сгорания являются CO2 (Г), H2О (Ж), и N2 (Г).
|
|
|
Использовать известные теплоты сгорания простых веществ:
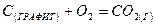 DН= – 393,795 кДж/моль;
DН= – 393,795 кДж/моль;
 DН= – 286,043 кДж/моль.
DН= – 286,043 кДж/моль.
Таблица 4
| Вариант | Вещество |  , кДж/моль , кДж/моль
|
 нитрометан нитрометан
| 709,278 | |
 нитроэтан нитроэтан
| 981,852 | |
 этиленгликоль этиленгликоль
| 1180,315 | |
 глицерин глицерин
| 1662,239 | |
 диметиламин диметиламин
| 1774,229 | |
 ацетон ацетон
| 1787,012 | |
 циклогексан циклогексан
| 3919,910 | |
 этилацетат этилацетат
| 2246,390 | |
 пропанол-1 пропанол-1
| 2011,853 | |
 этанол этанол
| 1370,680 | |
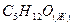 амиловый спирт амиловый спирт
| 3323,222 | |
 муравьиная кислота муравьиная кислота
| 254,580 | |
 * хлороформ * хлороформ
| 428,060 | |
 анилин анилин
| 3398,588 | |
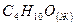 диэтиловый эфир диэтиловый эфир
| 2726,710 | |
 пиридин пиридин
| 2577,140 | |
 валериановая кислота валериановая кислота
| 2853,859 | |
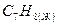 толуол толуол
| 3950,769 | |
 октан октан
| 5516,163 | |
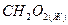 муравьиная кислота муравьиная кислота
| 254,580 |
Продолжение таблицы 4
| Вариант | Вещество |  , кДж/моль , кДж/моль
|
 бутанол бутанол
| 2671,900 | |
 ** хлорметан ** хлорметан
| 759,940 | |
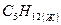 пентан пентан
| 3509,200 | |
 уксусная кислота уксусная кислота
| 874,580 | |
 нитробензол нитробензол
| 2884,00 | |
 ** хлорбензол ** хлорбензол
| 3110,300 | |
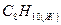 м-ксилол м-ксилол
| 4551,810 | |
 нитроглицерин нитроглицерин
| 1541,400 | |
 1,4-диоксан 1,4-диоксан
| 2316,560 | |
 бензол бензол
| 3267,580 |
* Продукты сгорания: CO2 (Г), Cl2(Ж) и HCl (Р-Р);
** Продукты сгорания: CO2 (Г), H2О(Ж) и HCl (Р-Р).
Решение:
Вычислим стандартную теплоту образования карбамида  . По определению теплота образования – это тепловой эффект реакции образования одного моля вещества из простых веществ при стандартных условиях. Следовательно, в задаче требуется найти тепловой эффект реакции:
. По определению теплота образования – это тепловой эффект реакции образования одного моля вещества из простых веществ при стандартных условиях. Следовательно, в задаче требуется найти тепловой эффект реакции:
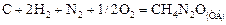 +
+ 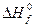 .
.
Для решения задачи применим метод комбинирования термохимических уравнений.
Воспользуемся изменениями энтальпий следующих реакций:
(а)  , DН1= –634,749 кДж/моль.
, DН1= –634,749 кДж/моль.
(b)  , DН2 = – 393,795 кДж/моль.
, DН2 = – 393,795 кДж/моль.
(c) 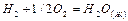 , DН3 = – 286,043 кДж/моль.
, DН3 = – 286,043 кДж/моль.
Необходимая нам реакция образования карбамида из простых веществ получается при сложении термохимических уравнений (b) и (c), за вычетом уравнения (а). Уравнение (c) необходимо умножить на коэффициент 2. Следовательно,

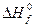 = –393,795 + 2·(–286,043) – (–634,749) = –331,132 кДж/моль.
= –393,795 + 2·(–286,043) – (–634,749) = –331,132 кДж/моль.
Справочная величина теплоты образования карбамида
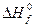 = –333,170 кДж/моль.
= –333,170 кДж/моль.
Задача №5
Рассчитайте теплоту сгорания газообразного вещества, если известна теплота сгорания данного вещества в жидком агрегатном состоянии и его мольная теплота испарения. Теплоту сгорания жидкого вещества возьмите в табл. 4, температуру кипения – из табл.5. Мольную теплоту испарения рассчитайте по формуле:
 , Дж/(моль·К)
, Дж/(моль·К)
Таблица 5
| Вариант | Вещество | ТКИП, К |
 нитрометан нитрометан
| ||
 нитроэтан нитроэтан
| ||
 этиленгликоль этиленгликоль
| ||
 глицерин глицерин
| ||
 диметиламин диметиламин
| ||
 ацетон ацетон
| ||
 циклогексан циклогексан
| ||
 этилацетат этилацетат
|
Продолжение таблицы 5
| Вариант | Вещество | ТКИП, К |
 пропанол-1 пропанол-1
| ||
 этанол этанол
| ||
 амиловый спирт амиловый спирт
| ||
 муравьиная кислота муравьиная кислота
| ||
 хлороформ хлороформ
| ||
 анилин анилин
| ||
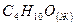 диэтиловый эфир диэтиловый эфир
| ||
 пиридин пиридин
| ||
 валериановая кислота валериановая кислота
| ||
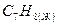 толуол толуол
| ||
 октан октан
| ||
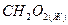 муравьиная кислота муравьиная кислота
| ||
 бутанол бутанол
| ||
 хлорметан хлорметан
| ||
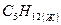 пентан пентан
| ||
 уксусная кислота уксусная кислота
| ||
 нитробензол нитробензол
| ||
 хлорбензол хлорбензол
| ||
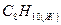 м-ксилол м-ксилол
| ||
 нитроглицерин нитроглицерин
| ||
 1,4-диоксан 1,4-диоксан
| ||
 бензол бензол
|
Решение:
Определим теплоту сгорания газообразного пропана, если известна теплота сгорания жидкого пропана (DH1= –2200 кДж/моль) и мольная теплота испарения жидкого пропана (DH2 = 20 кДж/моль). Для этого воспользуемся методом составления циклов из реакций с известной и неизвестной энтальпиями.
Составим термохимическую схему:

Рис. 1 - Термохимическая схема
Переход из начального состояния «газообразный пропан» в конечное состояние «продукты сгорания» можно совершить как напрямую, так и через промежуточное состояние «жидкий пропан». Согласно закону Гесса тепловой эффект не зависит от пути протекания процесса. Тепловой эффект перехода «газ–жидкость» равен по величине, но обратен по знаку тепловому эффекту перехода «жидкость-газ».
ΔН3 = –ΔН2 + ΔН1 = –20 + (–2200) = –2220 кДж/моль.
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 124; Нарушение авторских прав?; Мы поможем в написании вашей работы!