
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Анализ окрашенной лекарственной формы.
|
|
|
|
Подлинность.
Анализ инъекционных лекарственных форм.
Лабораторная работа №5. Раствор витамина В12 0,002% для инъекций.
Цель работы: Оценка качества анализируемой лекарственной формы.
Витамин В12 Цианокобаламин. - С63Н88СоN14О14Р M.масса. 1355,4 г/моль
Характерной химической особенностью молекулы цианокобаламина является наличие атома кобальта и цианогруппы, образующих координационный комплекс.

Основным способом идентификации и определения чистоты витамина В12 служит его спектральная характеристика. Раствор препарата- п розрачная жидкость от слабо розового до ярко-красного цвета.
0,002% раствор витамина В12 должен иметь характерный спектр поглощения с максимумами при длинах волн 278, 361 нм (в ультрафиолетовой области спектра) и 548 им (в видимой области спектра) и удельными коэффициентами поглощения 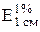 в указанных точках соответственно 115, 207 и 64.
в указанных точках соответственно 115, 207 и 64.
1. По собственной окраске раствора.
Фотометрические методы определения витамина B12, основаны на естественной красно-розовой окраске растворов цианокобаламина, обусловленной наличием кобальта в молекуле.
Определяют оптическую плотность (D) раствора, который готовят разведением препарата водой до содержания около 0,02мг В12 в 1мл, в кювете с толщиной слоя 1 см при длинах волн: 278±1нм; 361±1нм и 548±2нм. Раствор сравнения – вода.
Отношение  должно быть от 3,0 до 3,4.
должно быть от 3,0 до 3,4.
Отношение  должно быть от 1,7 до 1,88.
должно быть от 1,7 до 1,88.
2. Для качественной характеристики витамина B12 могут быть использованы и химические методы, основанные на цветных реакциях в результате различных превращений молекулы витамина. В качестве реакции подлинности используют реакцию с раствором нитрозо-Р-соли после разрушения витамина азотной кислотой и создания определенного значения рН среды.
|
|
|
Нитрозо-Р-соль равно как и  -нитрозо-
-нитрозо-  -нафтол, образуют окрашенные в красный цвет комплексы с кобальтом после разрушения молекулы витамина B12 .
-нафтол, образуют окрашенные в красный цвет комплексы с кобальтом после разрушения молекулы витамина B12 .
Нитрозо Р-соль

Выполнение реакции
1 мг препарата сплавляют с 0,05 г бисульфата калия в фарфоровом тигле, охлаждают, прибавляют 3 мл воды и нагревают до растворения плава. Затем нейтрализуют раствором едкого натра по фенолфталеину, прибавляют 0,5 г ацетата натрия, 0,5 мл разведенной уксусной кислоты и 0,5 мл 0,5% раствора нитрозо-Р-соли; появляется красное окрашивание, сохраняющееся после прибавления 0,5 мл соляной кислоты и кипячения в течение 1 минуты.
Количественное определение. Витамин В12определяют спектрофотометрическими методами.
1. По собственной окраске раствора.
Методика определения
Препарат разводят водой до содержания около 0,02мг В12 в 1мл, измеряют оптическую плотность полученного раствора на спектрофотометре в кювете с толщиной слоя 1 см при длине волны: 361±1нм. Раствор сравнения – вода.
Содержание витамина В12 вычисляют по формуле:
Х= D· 10 V1/207 V,%
D – оптическая плотность раствора;
207 – удельный показатель поглощения 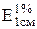 чистого цианокобаламина при длине волны 361 нм;;
чистого цианокобаламина при длине волны 361 нм;;
V1 – объем мерной колбы;
V – объем препарата (аликвота);
2.По цветной реакции кобальта с роданидом.
Определение кобальта основано на реакции с роданидом (тиоцианатом). В ацетоне кобальт образует с роданидом комплекс синего цвета:
Co2+ + 6CNS- = [Co(CNS)6]4-
Методика определения
1) Приготовление рабочего раствора.
Рабочий раствор кобальта (0,1мг/мл) готовят разведением стандартного раствора CoCl2 (1мг/мл). Для этого в мерную колбу на 50мл берут пипеткой 5мл стандартного раствора и доводят водой до метки.
2) Построение градуировочного графика.
В мерные колбы на 25мл последовательно наливают мерной пипеткой 1, 2, 3, 4, 5 мл рабочего раствора кобальта (0,1мг/мл). В первые четыре колбы добавляют дистиллированную воду до объема 5мл (т.е. 4, 3, 2, 1мл соответственно), затем во все колбы прибавляют по 0,5мл соляной кислоты 1 моль/л, по 5мл роданида аммония (50%) и до метки доливаем ацетон. Хорошо перемешивают. Измеряют оптическую плотность (D) полученного раствора на спектрофотометре или КФК при 590нм в кювете на 1см. Раствор сравнения – вода.
|
|
|
Полученные данные записывают в виде таблицы:
| № колбы | V пипетки, мл | CСо мг/мл *) | D |
| 1,0 | |||
| 2,0 | |||
| 3,0 | |||
| 4,0 | |||
| 5,0 |
*) Концентрацию кобальта рассчитывают по формуле:
СCo = Сраб.р-ра ·V / V1 ;
Где, V – объем пипетки;
V1 – объем мерной колбы;
По полученным данным строят градуировочный график в координатах:
ССо- D.
4)Определение концентрации кобальта в витамине В12.
После разрушения витамина В12 и создания оптимального значения рН, полученный раствор разводят (V2) до концентрации примерно 0,1 мг/мл, отбирают пипеткой 2мл (V) в мерную колбу на 25 мл (V1), добавляют 3мл воды, 0,5мл 1М НСl и 5мл 50% раствора роданида аммония. Доводят водой до метки. После перемешивания определяют оптическую плотность раствора в тех же условиях.
Концентрацию кобальта ССо в растворе находят по градуировочному графику.
Содержание Со в мг рассчитывают по формуле:
m(Со) = CCo·V1 V2 /V
где V2 – объем колбы, в которой разводили раствор после разрушения витамина В12;
Зная m(Со) и М(С63Н88СоN14О14Р) = 1355г/моль, можно рассчитать массу витамина В12 в ампуле и его массовую долю(ω) в %.
Лабораторная работа №6. Фурацилин. Раствор фурацилина 0,02%;
Цель работы: Оценка качества анализируемой лекарственной формы.
Фурацилин C6H6N4O4
 |
5-нитрофурфурола семикарбазон М.масса 198,14 г/моль
Очень мало растворим в воде, мало растворим в 95% спирте, практически нерастворим в эфире, растворим в щелочах.
Подлинность
*)
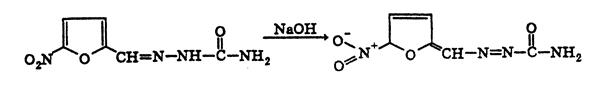
 |
**)
Реакции подлинности фурацилина:
| Реактив | Аналитический эффект реакции |
| Раствор едкого натра*) | оранжево-красное окрашивание |
| Растворы едкого натра и йода**) | оранжево-красное окрашивание и выделение аммиака |
| Ацетон и едкое кали | устойчивое серно-красное окрашивание |
| Диметилформамид | желтое окрашивание |
| Диметилформамид и едкое кали | фиолетовое окрашивание, на стенках пробирки – фиолетово-красное |
Цветные реакции на фурацилин:
|
|
|
| 95% этиловый спирт, 10% р-р CuSO4 | темно-красное окрашивание и осадок |
| 10% р-р NaOH, пергидроль и 30% р-р едкого натра | бледно-желтое окрашивание |
| 95% этиловый спирт и 5% р-р нитропруссида натрия | красное окрашивание и осадок |
| реактив Несслера | красновато-коричневое окрашивание и осадок |
Количественное определение. Фурацилин определяют фотометрическим и иодометрическим методами.
1.Фотометрическое определение по естественной окраске раствора методом стандартов.
Методика определения
1).Приготовление стандартного раствора фурацилина.
Для приготовления стандартного раствора 0,0200 г фурацилина, растворяют в 70-80 мл воды в мерной колбе вместимостью 100 мл при нагревании на водяной бане при 70-800С. После охлаждения объем раствора доводят водой до метки и хорошо перемешивают.
2) Определение концентрации фурацилина в лекарственной форме.
К 0,5 мл лекарственной формы прибавляют 7,5 мл воды, 2 мл 0,1 М раствора гидроксида натрия и перемешивают.(V1=10мл) Через 20 минут измеряют оптическую плотность окрашенного раствора (D1) с помощью фотоколориметра в кювете с длиной рабочего слоя 1 см при синем светофильтре (390-400 нм). В качестве раствора сравнения используют воду. Параллельно проводят реакцию с 0,5 мл 0,02%-ного стандартного раствора фурацилина и измеряют оптическую плотность полученного раствора (Dст.)
Содержание фурацилина (%) вычисляют по формуле:
ω (C6H6N4O4) = D1· 100 / Dст. 0,5·1000,%

2. Иодометрическое определение
 |
 |
Фурацилин определяют методом обратного иодометрического титрования. В щелочной среде иод образует гипоиодид, который реагирует с фурацилином. После окончания процесса окисления раствор подкисляют. Выделившийся избыток иода оттитровывают тиосульфатом натрия.
Методика определения
1) Около 0,1 г препарата (точная навеска) помещают в мерную колбу вместимостью 500 мл, для улучшения растворимости прибавляют 4г хлорида натрия, 300мл воды и растворяют при подогревании до 70-800С на водяной бане. Охлажденный раствор доводят до метки и перемешивают.
|
|
|
2) К 5 мл 0,0100н раствора иода (V1)., помещенного в колбу для титрования вместимостью 50 мл, прибавляют 0,1 мл раствора гидроксида натрия и 5 мл испытуемого раствора. Через 1-2 минуты к раствору прибавляют 2 мл разведенной серной кислоты и выделившийся иод титруют из микробюретки 0,0100н раствором тиосульфата натрия (V2).. Когда раствор приобретет соломенно-желтый цвет, прибавляют 1% раствор крахмала и продолжают титровать до исчезновения синей окраски раствора. Параллельно проводят контрольный опыт.
1 мл 0,0100н раствора иода соответствует 0,0004954 г фурацилина
Расчет содержания фурацилина проводят по формуле:
Х( C6H6N4O4 )= 
W - объем мерной колбы, в которой производили разведение;
а - объем раствора, взятый для анализа (аликвота);
V1 - объем титрованного раствора J2, добавленного до начала титрования;
V2 - объем титрованного раствора J2, израсходованного на титрование, мл;
Т -титр по определяемому веществу - масса определяемого вещества, соответствующая 1мл титрованного рабочего раствора, г/мл;
Н - навеска или объем лекарственной формы.
К1 и К2 -коэффициенты поправки титрованных растворов (К =1, если концентрация раствора равна 0.1000н).
Примечание: Содержание фурацилина в препарате должно быть не менее 97,5%
.
6.6. Анализ двухкомпонентной порошковой лекарственной формы без разделения.
Лабораторная работа №7 А нализ порошков состава:
Кислоты аскорбиновой 0.02; 0.05; 0.1; 0.2.
Глюкозы 0.2; 0.25; 0.3; 0.4.
Цель работы: Оценка качества сложной анализируемой лекарственной формы без разделения ингредиентов.
1.Кислота аскорбиновая (витамин С). С6Н8О6 М.масса 176,13 г/моль
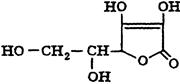
Структура аскорбиновой кислоты может быть представлена двумя таутомерными формулами:
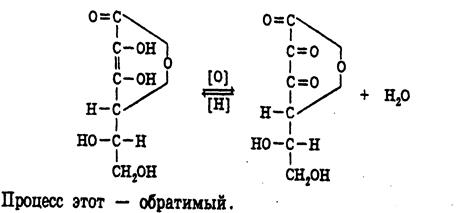
Кислотные свойства кислоте аскорбиновой придает наличие в молекуле двух енольных радикалов. В разбавленных растворах щелочей она ведет себя как одноосновная кислота.

Эта реакция лежит в основе определения аскорбиновой кислоты методом нейтрализации.
Кислотные свойства кислоты аскорбиновой используют также для испытания подлинности. После добавления карбоната натрия в водном растворе происходит образование натриевой соли кислоты аскорбиновой, которая с сульфатом железа (Ш) образует соль темно-фиолетового цвета. Окраска исчезает после добавления разведенной серной кислоты.

Подлинность: Подлинность аскорбиновой кислоты устанавливают также реакцией «серебряного зеркала», потому что она проявляет восстановительные свойства, окисляясь до дегидроаскорбиновой кислоты.
Выполнение реакции.
0.005 – 0.01г препарата растворяют в капле воды, прибавляют каплю раствора нитрата серебра, образуется темно – серый осадок металлического серебра.

2.Глюкоза С6Н12О6 Н2О М. масса. 98,17г/моль
Структура глюкозы может быть представлена двумя формулами:


Подлинность. Подлинность глюкозы устанавливают по реакциям альдегидной группы: реакцией «серебряного зеркала (1) или реакцией с сульфатом меди в щелочной среде (2), после разрушения аскорбиновой кислоты действием 30% раствора Н2О2 и аммиака.
Выполнение реакций
0.05 – 0.1г порошка растворяют в 1 – 2 мл воды, прибавляют по 2 –3 капли пергидроля и аммиака и кипятят 2 – 3мин. После охлаждения проводят реакции на глюкозу (1) и (2).
1) При добавлении сульфата меди и подщелачивании глюкоза образует комплексное соединение фиолетово-синего цвета. Эта реакция одновременно доказывает наличие как гидроксильных, так и альдегидной, (восстанавливающей медь при стоянии) групп..
2) 0.01 г препарата растворяют в 1 мл воды, прибавляют 1 – 2 капли нитрата серебра, 2 – 3 капли раствора аммиака и нагревают, выделяется металлическое серебро в виде зеркала или серого осадка.
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 194; Нарушение авторских прав?; Мы поможем в написании вашей работы!