
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изменение энтропии при смешении идеальных газов в изобарно-изотермическом процессе
|
|
|
|
В смеси идеальные газы не взаимодействуют друг с другом и энтропия смеси идеальных газов будет равна сумме энтропий этих газов, когда каждый из них в отдельности занимает при температуре смеси тот же объем, что и вся смесь (теорема Гиббса ). Если смешиваются n 1 моль первого газа, занимавшего объем V 1 при давлении Р, с n 2 моль второго газа, занимавшего объем V 2 при том же давлении Р, при постоянной температуре и общем давлении Р, то изменение энтропии при смешении ∆ mixS (подстрочный индекс от mix ing – смешение) складывается из изменения энтропии каждого газа при его изотермическом расширении от объема V 1 (V 2) до объема V 1 + V 2. При этом парциальное давление каждого газа изменяется от Р до Рi = P ∙ xi (закон Дальтона для смеси идеальных газов, поскольку исходное давление каждого из газов равно конечному давлению смеси Р = Р смеси), где х i – мольная доля данного газа в смеси.
Изменение энтропии как функции состояния в результате смешения двух газов будет равно разности
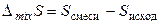 ,
,
где S смеси – энтропия смеси газов, а S исход – сумма энтропий газов до смешения. Энтропия газов до смешения S исход в соответствии с уравнением (3.41) будет равна
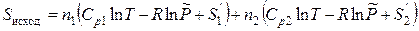 , (3.42)
, (3.42)
а энтропия смеси газов –
 ,
,
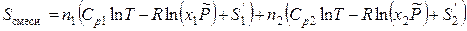 , (3.43)
, (3.43)
где 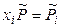 – относительное парциальное давление данного газа в смеси.
– относительное парциальное давление данного газа в смеси.
Тогда энтропия смешения газов будет определяться соотношением
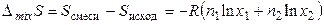 (3.44)
(3.44)
Изменение энтропии при образовании 1 моль смеси идеальных газов будет равно
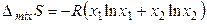 (3.45)
(3.45)
Согласно (3.45) ∆ mixS > 0, так как хi < 1 и ln хi < 0. Если смешивается n идеальных газов при Т, Р = const, то энтропия смешения в расчете на 1 моль смеси будет равна
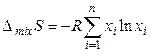 . (3.46)
. (3.46)
Следует обратить внимание, что энтропия газа при Т = const изменяется, если только изменяется его парциальное давление.
|
|
|
Уравнение для расчета энтропии смешения можно также легко получить как сумму изменений энтропий каждого газа при их изотермическом расширении до объема смеси:
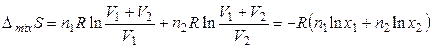 . (3.47)
. (3.47)
Из уравнения (3.47) следует, что возрастание энтропии при смешении двух идеальных газов зависит только от количества молей газов, но не зависит от их природы. В предельном случае, когда смешивается один и тот же газ, разделенный перегородкой на две части, увеличения энтропии, согласно (3.47), не должно происходить, так как парциальное давление газа не меняется и никакого термодинамического процесса не происходит. Таким образом, смешение двух идентичных газов нельзя рассматривать как предельный случай смешения двух различных газов. При переходе от образования смеси сколь угодно близких (различимых) газов к смеси одинаковых (неразличимых) газов ∆ mixS испытывает скачок. Это утверждение получило название парадокса Гиббса.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 6953; Нарушение авторских прав?; Мы поможем в написании вашей работы!