
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вычисление изменения энтропии в необратимых процессах
|
|
|
|
Для необратимых процессов dS > δQ / T. Но энтропия – функция состояния и ее изменение не зависит от пути процесса, а определяется конечным и начальным состоянием системы. Если из состояния 1 система перешла в состояние 2 один раз обратимо, а другой раз необратимо, то dS обр = dS необр. Теплота же обратимого процесса δQ обр > δQ необр. Поэтому для вычисления изменения энтропии в необратимом (неравновесном) процессе его следует заменить процессом, протекающем через ряд обратимых стадий, причем начальное и конечное состояния в обоих процессах должны совпадать.
Например, необходимо определить изменение энтропии при замерзании 1 моля переохлажденной воды при 263,15 К и давлении 1 атм. Так как переохлажденная жидкость не может находиться в равновесии с твердой фазой при этой температуре и давлении, то этот процесс является необратимым. Следовательно, вычислить изменение энтропии по теплоте кристаллизации воды при 263,15 К нельзя. Но необратимый процесс кристаллизации переохлажденной воды можно мысленно заменить следующими тремя квазистатическими процессами:
1. Нагревание 1 моль переохлажденной воды от 263,15 К до 273,15 К. В этом процессе изменение энтропии Δ S 1 будет равно
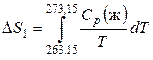 .
.
2. Обратимая кристаллизация воды при температуре плавления льда 273,15 К:
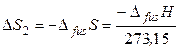 ,
,
где 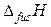 – энтальпия плавления льда.
– энтальпия плавления льда.
3. Обратимое охлаждение льда от 273,15 К до 263,15 К, тогда
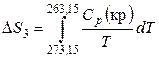 .
.
В результате изменение энтропии при кристаллизации переохлажденной воды при 263,15 К будет равно
Δ S = Δ S 1 + Δ S 2 + Δ S 3.
Рассмотрим также в качестве примера вычисление изменения энтропии в следующем необратимом процессе:
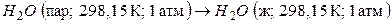 .
.
(Пар при температуре 25 оС и давлении 1 атм не находится в равновесии с жидкой водой, находящихся в тех же условиях).
|
|
|
Если посчитать этот процесс обратимым, то
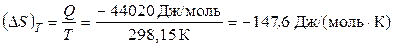 ,
,
где Q – теплота конденсации воды при 298,15 К.
Ответ, конечно, не верен, так как рассматриваемый процесс является необратимым. Заменим этот необратимый процесс совокупностью обратимых процессов по схеме:
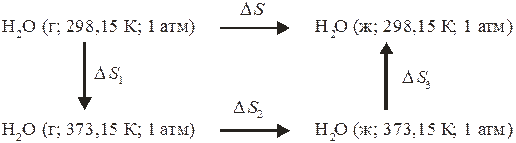
Тогда
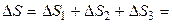
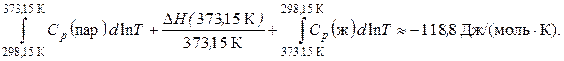
где 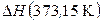 – теплота конденсации пара при 373,15 К.
– теплота конденсации пара при 373,15 К.
Возможен и другой вариант расчета по схеме:
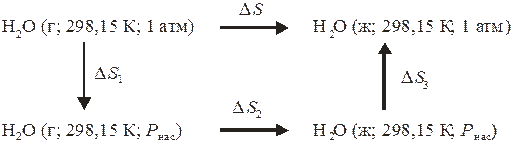
Будем рассматривать пар как идеальный газ, тогда для первого процесса (расширения пара) справедливо:
 ,
, 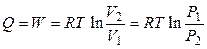 ,
,
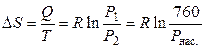 ,
,
где P нас. = 3166 Па – давление насышенного пара воды при 298,15 К.
Изменение энтропии в третьем процессе (как будет доказано в дальнейшем) мало и им можно пренебречь, то есть 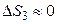 .
.
Итак,
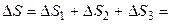
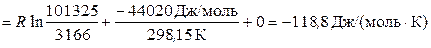
Следует отметить, что действительно
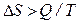 ,
,
что и характерно для необратимых процессов.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1619; Нарушение авторских прав?; Мы поможем в написании вашей работы!