
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы химической связи
|
|
|
|
ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
Существует два основных типа химической связи – ионная и ковалентная. Ионная связь связана с переходом электрона (электронов) от одного атома к другому и образованием противоположно заряженных ионов, образующих молекулу за счёт электростатического притяжения.
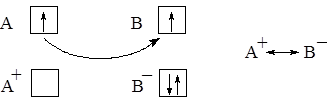
Связь, образованная электронами, принадлежащими обоим атомам, называется ковалентной. Её обозначают чертой или точками:
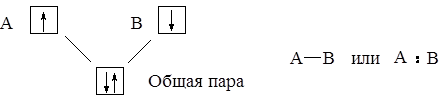
Строго говоря, общая пара электронов принадлежит “на равных” обоим атомам только в том случае, когда атомы одинаковы. При разных атомах общая пара смещена к одному из атомов в соответствии с их электроотрицательностью (ЭО).
Электроотрицательность определяется как суммарная характеристика способности атома отдавать и присоединять электроны при образовании химической связи. Принципов построения и соответственно шкал ЭО много. Например, по Малликену величина ЭО вычисляется как полусумма энергии ионизации и сродства к электрону. Наиболее распространена шкала Полинга. Ниже приведена качественная шкала величин ЭО:
ЭОF > ЭОO > ЭОN» ЭОCl > ЭОS» ЭОC > ЭОH» ЭОP > ЭОB»
» ЭОAs > ЭОSi > ЭОGe > ЭОBe > ЭОMg > ЭОCa» ЭОLi > ЭОNa > ЭОK > ЭОCs
В практических операциях важны не сами величины ЭО, а их разности. Порядок же изменения этих разностей совпадает для разных шкал ЭО. Чем больше разница величин ЭО, тем больше общая пара электронов смещена к одному из атомов, тем полярнее связь. Например:
MgF2 NaCl PF3 AsCl3
D(ЭО) 2,8 2,6 1,9 1,5
Из приведенных цифр следует, что наиболее полярная связь в MgF2, наименее полярная – в AsCl3. Ковалентную связь, образованную различными атомами, где наблюдается смещение общей электронной пары, называют полярной ковалентной связью. Это самый распространенный тип химической связи.
|
|
|
Смещение электронной плотности при образовании ковалентной связи, обусловленное различием в величинах ЭО атомов, можно учесть, приписав атомам так называемые эффективные заряды (d) в единицах заряда электрона. Это в значительной степени условные величины, так как электронное облако делокализовано и его нельзя “разделить” между ядрами. Эффективные заряды определяют экспериментально из спектральных данных.
Если связь чисто ковалентная, то d=0. В ионной молекуле эффективный заряд равен заряду иона, для остальных полярных молекул (точнее молекул с полярными связями) d имеет промежуточное значение. Это позволяет трактовать полярную ковалентную связь как комбинацию из ионной и чисто ковалентной связей. Например, в молекуле хлороводорода эффективный заряд на атоме водорода +0,2; на атоме хлора –0,2 соответственно. При наличии чисто ковалентной связи эффективный заряд на атоме был бы равен нулю, а при ионной связи составил бы ±1. Таким образом, имеющееся распределение электронной плотности в молекуле хлороводорода можно представить следующим образом: 0,2×1 + 0,8×0. Другими словами, в молекуле HCl лишь 20% связи носит ионный характер, а на 80% связь ковалентная.
В молекуле NaCl, существующей в газовой фазе, эффективные заряды на атомах составляют соответственно +0,8 и –0,8. Следовательно, в этом случае связь на 80% носит ионный характер. В молекуле ВаО (двойная связь) эффективные заряды ±0,43, откуда следует, что степень ионности связи в этой молекуле составляет

Даже в таких молекулах как CsF и RbF, где разница ЭО атомов максимальна, эффективные заряды не равны единице. Это фактически указывает на то, что говорить о ионной связи можно лишь с какой-то степенью точности.
Ковалентная связь направлена и насыщаема. Направленность обусловлена конкретной ориентацией электронных орбиталей в пространстве. Насыщаемость, т. е. невозможность образования связей больше определённого числа, связана с ограниченной емкостью валентной оболочки. Ионная же связь в силу сферической симметрии кулоновского потенциала является связью ненаправленной и ненасыщенной.
|
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 624; Нарушение авторских прав?; Мы поможем в написании вашей работы!