
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Донорно-акцепторный механизм образования связи
|
|
|
|
Образование химической связи возможно и за счёт пары электронов, принадлежавших до образования связи одному из атомов:
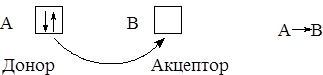
Связь, образованную таким способом, часто называют донорно-акцепторной, но более правильно говорить о донорно-акцепторном механизме образования связи.
Тот же результат мы получили, рассматривая несколько иначе механизм образования связи. Первоначально атом А имеет пару электронов, а атом В – свободную орбиталь. Атом А отдаёт один электрон атому В, первый становится катионом с неспаренным электроном, а второй – анионом с неспаренным электроном. Далее эти частицы традиционным способом образуют полярную ковалентную связь:
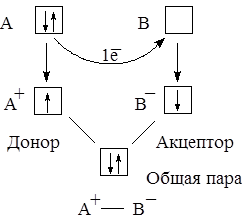
В двух вариантах одинакова исходная позиция – у атома А пара электронов, у атома В свободная орбиталь, и одинаков результат – образование однократной связи. Следовательно, оба варианта рассмотрения механизма образования связи есть по существу одно и то же.
В качестве примеров, иллюстрирующих донорно-акцепторный механизм образования связи, рассмотрим молекулы СО и HNO3. Характеристики связи в молекуле СО – энергия связи, межатомное расстояние, силовая постоянная – близки к характеристикам связи в молекуле N2. Напрашивается вывод, что и связь в этих молекулах одинаковая, т. е. тройная.
Строение внешнего электронного слоя атомов С и О следующее:

По два неспаренных электрона, имеющихся у каждого из атомов, позволяют образовать двойную связь. Третья связь образуется по донорно-акцепторному механизму за счёт пары электронов 2р-оболочки атома кислорода и пустой оболочки атома углерода:
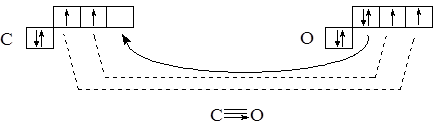
В другом варианте допускаем, что атом кислорода отдаёт один электрон атому углерода. При этом атом кислорода становится катионом с тремя неспаренными электронами, а атом углерода – анионом также с тремя неспаренными электронами. Обратим внимание, что указанные катион и анион являются электронными аналогами атома азота и образуют тройную связь:
|
|
|
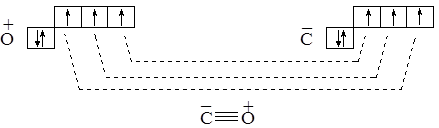
Разумеется, подобное объяснение организации связи в молекуле СО трудно признать удачным, ведь приходится допускать, что более электроотрицательный атом передает электрон менее электроотрицательному. Ниже мы познакомимся с иным методом описания химической связи в молекуле СО, позволяющим объяснить тройную связь в этой молекуле без привлечения сомнительных допущений.
В молекуле азотной кислоты атом азота за счёт трёх неспаренных электронов образует три связи: двойную с атомом кислорода и однократную с другим атомом кислорода, входящим в состав группы ОН. Еще один атом кислорода может быть присоединен к атому азота за счёт донорно-акцепторного взаимодействия:
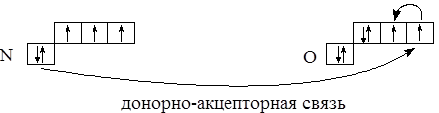
Предварительно в атоме кислорода следует “загнать” на одну орбиталь неспаренные электроны и освободить тем самым вторую орбиталь. Схематично образование связи может быть представлено следующим образом:
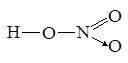
Тот же результат получаем, допуская, что атом азота отдал электрон атому кислорода, превратившись при этом в катион N+, обладающий четырьмя неспаренными электронами. Анион О– имеет только один неспаренный электрон. Образование связи выглядит так:
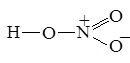
Изображённые так называемые валентные схемы не совсем точно передают реальное распределение электронной плотности в молекуле азотной кислоты, ведь атомы кислорода неразличимы. Поэтому наряду с представленными валентными схемами необходимо привести и вторые:
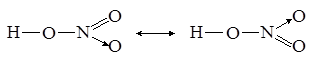
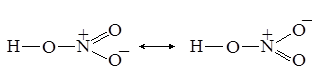
Знак ↔ означает “одновременно существуют”. Таким образом, связь между азотом и кислородом в среднем полуторная:
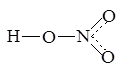
Азот имеет в этой молекуле валентность четыре, а данная процедура носит название “наложение валентных схем”. Ниже она будет обсуждена более подробно.
|
|
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 6293; Нарушение авторских прав?; Мы поможем в написании вашей работы!