
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изменение энергии Гиббса в окислительно-восстановительных реакциях
|
|
|
|
Традиционно химические реакции делят на обменные и окислительно-восстановительные. Под последними понимают реакции, в которых происходит изменение степеней окисления атомов в молекулах реагирующих веществ. Для подобных процессов критерий самопроизвольного протекания может быть выражен через так называемые величины электродных потенциалов.
Рассмотрим систему, состоящую из металлического электрода, например медного, погруженного в раствор соли этого металла. Концентрация ионов Cu2+ в металле при данных условиях постоянна, концентрация же этих ионов в растворе определяется концентрацией соли. В зависимости от последней на границе металл-раствор начинается либо переход ионов Cu2+ в раствор, либо осаждение этих ионов на поверхности электрода. Так или иначе, поверхность металла становится заряженной, для компенсации этого заряда из раствора подойдут к поверхности металла ионы противоположного знака. На границе металл-раствор возникает так называемый двойной электрический слой, характеризующийся соответствующим скачком потенциала. Экспериментально измерить его величину невозможно.
Поскольку измерению поддается лишь величина электродвижущей силы (ЭДС) электрохимической цепи, то опытным путем можно определить только относительные величины так называемых электродных потенциалов, ЭДС цепи, составленной из данного электрода и некоторого стандартного электрода, потенциал которого условно принимают равным нулю. В качестве стандартного электрода или электрода сравнения принят обратимый водородный электрод, в котором газообразный водород находится при давлении 1 атм и насыщает платиновый электрод. Раствор, в который помещен водородный электрод, содержит ионы водорода с активностью, равной единице.
|
|
|
Таким образом, электродным потенциалом Е данного электрода называют ЭДС элемента, составленного из этого электрода и водородного электрода. Например, для нахождения электродного потенциала меди надо составить следующий электрохимический элемент:
(-) Pt, H2 | H+,aq | Cu2+,aq | Cu(+).
Понятно, что для записи уравнений электродных полуреакций и введения соответствующей системы знаков величин электродных потенциалов возможны два подхода. Наиболее распространен вариант, где электродные полуреакции записывают в окислительной форме, а система знаков такова, что написанному медному электроду соответствует (в стандартных условиях) положительное значение электродного потенциала. В этой системе знаков значение ЭДС (j) процесса будет находиться по соотношению:
j = Еокисл – Евосст. (1.27)
Гораздо более многочисленны электроды, реакции на которых не связаны с выделением веществ из раствора или растворением материала электрода. Перенос электронов в таких реакциях связан с изменением зарядов ионов в растворе. Примером такого электрода является электрод, состоящий из платиновой пластины, опущенной в раствор, содержащий соли железа (II) и (III). Платина индифферентна к указанным соединениям и служит лишь переносчиком электронов:
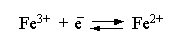
Платиновый электрод получает положительный заряд и притягивает анионы из раствора; на поверхности электрода образуется двойной электрический слой и возникает соответствующий скачок потенциала. Его величина (при постоянных температуре и давлении) зависит только от концентраций солей железа (I1) и (III) в растворе. Знак потенциала и его величина определяются относительно водородного электрода.
Некоторые величины стандартных электродных потенциалов при 298,15 К приведены в табл. 2 приложения.
|
|
|
Полезная работа Апол электрохимического элемента представляет собой работу электрического тока и может быть найдена:
Аэлек = qj = nFj, (1.28)
где q - количество электричества, n – число электронов, отдаваемых или присоединяемых в элементарном акте, F – число Фарадея.
Согласно (1.20) для обратимых процессов DG= –Апол = –nFj. Самопроизвольному течению процесса соответствует отрицательное значение энергии Гиббса, следовательно, для реакций, протекающих в электрохимических элементах (окислительно-восстановительных реакций) должно выполняться: –nFj < 0. Поскольку n и F положительны, то приходим к заключению, что самопроизвольно протекают те окислительно-восстановительные реакции, для которых величины ЭДС положительны. Например, определим, возможно ли в стандартных условиях окисление перманганатом калия ионов Fe2+ и Co2+ до Fe3+ и Со3+ в кислой среде. Величины электродных потенциалов:
MnO4– + 8H+ + 5ē = Mn2+ + 4H2O; 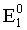 =1,51 В (окисл);
=1,51 В (окисл);
Fe3+ + ē = Fe2+; 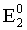 =0,77 В (восст);
=0,77 В (восст);
Co3+ + ē = Co2+; 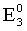 =1,82 В (восст).
=1,82 В (восст).
Для первого процесса
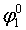 =
=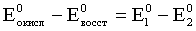 = 1,51–0,77 = 0,74 В.
= 1,51–0,77 = 0,74 В.
Для второго процесса
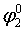 =
=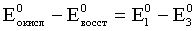 = 1,51–1,82 = –0,31 В.
= 1,51–1,82 = –0,31 В.
Как видно, самопроизвольное течение возможно лишь для первого процесса. Вторая реакция запрещена, перманганат-ион не может окислить ион Co2+ до Co3+, а наоборот - в кислой среде ион Co3+ окисляет Mn2+ до перманганат-иона.
Зависимость величины электродного потенциала от температуры и концентраций реагирующих веществ будет приведена ниже.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2639; Нарушение авторских прав?; Мы поможем в написании вашей работы!