
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория активных соударений
|
|
|
|
Теория активных соударений была сформулирована С. Аррениусом в 1889 году. Основные положения теории:
1) для протекания химической реакции необходимо соударение между молекулами исходных веществ;
2) не каждое соударение молекул приводит к химическому превращению; к нему приводит лишь активное соударение, то есть
соударения, между молекулами, обладающими большим запасом энергии. Минимальный запас энергии, которым должны обладать молекулы исходных веществ, чтобы соударения между ними были активными, называется энергетическим барьером реакции (например, азот и кислород воздуха не могут преодолеть энергетический барьер). Каждая реакция характеризуется своим энергетическим барьером. Разберёмся с этим.
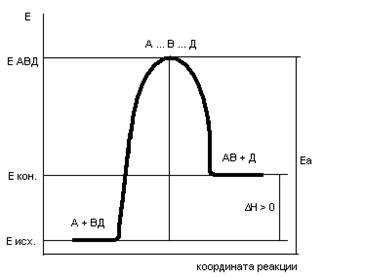
Энергетические диаграммы химических реакций.
Рассмотрим
В качестве абсциссы в этих диаграммах используется так называемая координата реакции. Вообще говоря, она является сложной функцией межатомных расстояний. Но для практических целей и простых молекул можно считать, что она характеризует изменения в межатомных расстояниях, которые происходят при сближении исходных молекул, образующих активированный комплекс, и взаимном удалении продуктов реакции при распаде активированного комплекса. По оси ординат откладывается потенциальная энергия всей системы.
∆Н < 0
То дополнительное количество энергии, которое надо добавить к средней энергии молекул исходных веществ, чтобы соударение между молекулами исходных веществ было активным, называется энергией активации (Еа).
Энергия активации ощутимо влияет на значение константы скорости реакции и ее зависимости от температуры: чем больше Еа, тем меньше константа скорости и тем значительнее влияет на нее изменение температуры.
|
|
|

Рис.5. Энергетическая диаграмма реакции А + В = С + Д
Константа скорости реакции связана с энергией активации сложной зависимостью, описанной уравнением Аррениуса:
k=A× е–Ea/RT (18) 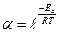
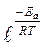
где А – предэкспоненциальный множитель; Еа – энергия активации, R – универсальная газовая постоянная, равная 8,31 дж/моль–1К–1; Т – абсолютная температура; е – основание натуральных логарифмов.
Однако наблюдаемые константы скорости реакции, как правило, гораздо меньше, вычисленных по уравнению (18). Поэтому уравнение (18) для константы скорости реакции видоизменяют следующим образом:
k=PZе –Ea/RT, (19) 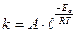
где Z – теоретическое число столкновений, а Р – так называемый фактор вероятности или стерический, учитывает все влияния, вызывающие отклонения от идеального уравнения. Для реакции между двумя молекулами с достаточной энергией активации необходима их определенная взаимная ориентация при соударении. Этот фактор действует во многих случаях, особенно при реакциях между сложными молекулами. Необходимость ориентации может заметно тормозить даже сравнительно простые реакции. Хорошо изученным примером является реакция H2 + I2 ® 2HI. Реакция происходит при простом соударении молекулы водорода и молекулы йода с одновременным образованием двух молекул иодоводорода.
Однако, для того, чтобы такое простое соударение дало две молекулы иодоводорода, надо, чтобы ориентация молекулы была сходна с той, которая изображена на рис.6 а.
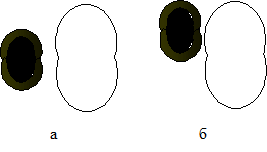
Рис. 6 а – благоприятная для реакции ориентация молекул водорода и йода при
столкновении;
б – неблагоприятная для реакции ориентация при столкновении молекул
водорода и йода.
Заметьте, что неблагоприятных способов ориентации может быть гораздо больше, чем благоприятных.
Энергия активации этой реакции невелика, но скорость довольно мала. Это вызвано сравнительно жесткими геометрическими требованиями. Было действительно установлено, что соударения, на подобие показанного на рис 6 б, имеют значительно меньше шансов привести к реакции, чем соударения, показанные на рис 6а. Соударения, при которых молекулы сталкиваются концами, еще менее продуктивны.
|
|
|
При сравнении уравнений (18) и (19) следует, что A = PZ, т.е. А в уравнении Аррениуса (18) характеризует число соударений с благоприятной ориентацией. Используя уравнение Аррениуса (18), можно определить энергию активации Еа. Для этого уравнение Аррениуса удобно применять в логарифмической форме:
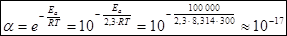
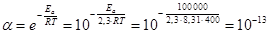
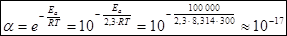
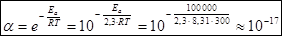 lnk = lnA –
lnk = lnA – 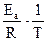 (20)
(20) 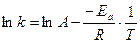
Переходя к десятичным логарифмам, имеем:
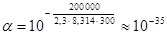 lgk =
lgk = 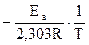 + lgA (21)
+ lgA (21)
Если построить график зависимости экспериментальных величин lgk от 1/Т (рис.7), то получим прямую, отсекающую на оси ординат отрезок, равный lgA (откуда можно определить А), и имеющую тангенс угла, равный:
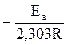 , т.е. tga =
, т.е. tga =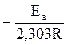 ; откуда Ea = –2,303Rtgα α 22)
; откуда Ea = –2,303Rtgα α 22)
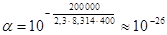
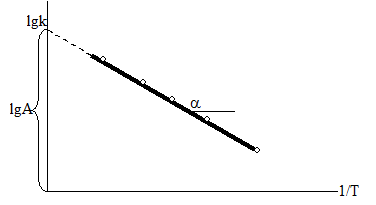
Рис.7. График зависимости lgk от обратной абсолютной температуры.
tga =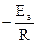 ;
;
При увеличении температуры константа скорости реакции возрастает, т.к. возрастает и число активных соударений в связи с увеличением среднего запаса энергии молекул реагирующих веществ. Из уравнения Аррениуса (18) видно, что константа скорости реакции k является произведением двух сомножителей: предэкспоненциального множителя А и экспоненциального множителя е–Ea/RT. Предэкспоненциальный множитель А практически не зависит от температуры, т.к. последняя не влияет на взаимную ориентацию газовых молекул. Экспоненциальный множитель е–Ea/RT, который характеризует долю активных соударений от общего числа двойных соударений, сильно зависит от температуры. Например, при повышении температуры на 1000С предэкспоненциальный множитель А увеличивается в 1,2 раза, в то время как экспоненциальный множитель в 20000 раз, т.е. доля активных соударений возрастает от общего числа соударений, а значит, возрастает и скорость химической реакции. Кроме того, повышение температуры ведет к уменьшению степени е, что является математическим подтверждением увеличения значения экспоненциального множителя.
Теория активных соударений позволяет, зная энергию активации, рассчитать общее число эффективных соударений, а отсюда – скорость реакции. Но эта теория не объясняет механизм самого соударения, что является ее недостатком.
|
|
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 9612; Нарушение авторских прав?; Мы поможем в написании вашей работы!