
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Понижение температуры замерзания растворов
|
|
|
|
При охлаждении разбавленных растворов нелетучих веществ при определенной температуре выкристаллизовывается растворитель, т.е. появляется твердая фаза, образованная чистым растворителем. Рассмотрим разбавленный раствор нелетучего вещества, находящийся в равновесии с твердым растворителем. Тогда в соответствии с теоремой Гиббса химический потенциал растворителя в растворе 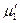 и химический потенциал твердого растворителя
и химический потенциал твердого растворителя 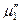 одинаковы:
одинаковы:
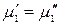
Химический потенциал растворителя в растворе при постоянном давлении является функцией состава раствора и температуры, а твердого растворителя, находящегося в равновесии с раствором – функцией только температуры:
 .
.
Продифференцируем
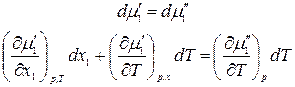
Проведя аналогичные предыдущим преобразования, получим:
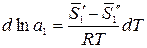
где 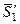 – парциальная мольная энтропия растворителя в растворе данного состава;
– парциальная мольная энтропия растворителя в растворе данного состава;
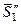 – мольная энтропия твердого чистого растворителя.
– мольная энтропия твердого чистого растворителя.
Разность, стоящая в числителе, равна парциальной мольной энтропии плавления:

Так как раствор разбавленный, то можно принять, что парциальная мольная энтропия плавления растворителя из раствора равна мольной энтропии плавления чистого растворителя:
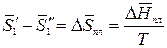 ,
,
 .
.
Аналогично предыдущему разделу можем принять, что
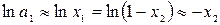 ,
,
тогда
 .
.
Процессы плавления и кристаллизации противоположны и идут при
Т = Тпл = Тз = const. Пусть температура замерзания чистого растворителя равна Тз0, а раствора – Тз. Мольная доля растворенного вещества в чистом растворителе х2 = 0, а в растворе – х2. Проинтегрируем в интервале Тз0 до Тз:
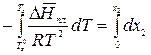 ;
;
 ;
;
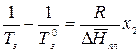
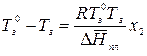
Аналогично заменяем  на
на 

 Из полученного уравнения следует, что раствор нелетучего вещества замерзает при более низкой температуре, чем чистый растворитель (рис. 2.7). Понижение температуры замерзания разбавленного раствора нелетучего вещества по сравнению с температурой замерзания чистого растворителя прямо пропорционально мольной доле растворенного вещества.
Из полученного уравнения следует, что раствор нелетучего вещества замерзает при более низкой температуре, чем чистый растворитель (рис. 2.7). Понижение температуры замерзания разбавленного раствора нелетучего вещества по сравнению с температурой замерзания чистого растворителя прямо пропорционально мольной доле растворенного вещества.
|
|
|
На рисунке:
|
Тз – температура замерзания раствора.
Из рисунка видно, что Тз < Тз0.
Выразим мольную долю растворенного вещества через моляльность:
 ,
,
где К – криоскопическая константа растворителя.
Криоскопическая постоянная зависит от свойств растворителя и не зависит от природы растворенного вещества. Физический смысл криоскопической константы: К численно равна понижению температуры замерзания раствора с концентрацией 1 моль/1000 г растворителя.

Значения К для различных растворителей приведены в справочной литературе.
С учетом диссоциации растворенного вещества получим

Методы анализа, основанные на измерении понижения температуры замерзания, называются криоскопическими. Криоскопический метод также применяется для определения молярной массы, концентрации и степени диссоциации растворенного вещества и является более точным, чем эбуллиоскопический.
 .
.
|
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 547; Нарушение авторских прав?; Мы поможем в написании вашей работы!