
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реальные газы. Уравнение Ван-дер-Ваальса
|
|
|
|
Метастабильные состояния.
Для кристаллизации вещества необходимо наличие центров кристаллизации – кристаллических зародышей, которыми могут быть не только кристаллики основного вещества, но и примеси, а также пыль, сажа и т.д.
Отсутствие центров кристаллизации в чистой жидкости затрудняет образование макроскопических кристаллов и вещество, оставаясь в жидком состоянии, можно охладить до температуры ниже температуры кристаллизации. При этом образуется переохлаждённая жидкость, это метастабильное (неустойчивое) состояние вещества.
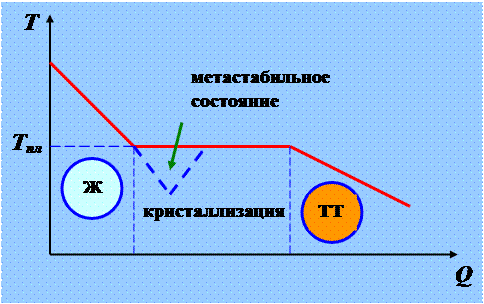

Аналогичное явление может наблюдаться при кипении жидкости. Хорошо очищенная жидкость (без газа, пыли, сажи и т.д.) может быть нагрета до температуры выше температуры кипения, это – перегретая жидкость, представляющая также метастабильное состояние вещества.




Для реальных газов необходимо учитывать размеры молекул и их взаимодействие друг с другом, поэтому уравнение Менделеева-Клапейрона для реальных газов непригодно.
Собственный объём молекул и силы межмолекулярного взаимодействия учитывает уравнение Ван-дер-Ваальса.
Уравнение Менделеева-Клапейрона PVm = RT (для 1 моля газа).
В него внесены два исправления:
1) Учёт собственного объёма молекул.
Наличие сил отталкивания, которые противодействуют проникновению в занятой молекулой объём других молекул, сводится к тому, что свободный объём в котором могут двигаться молекулы, будет не Vm, а (Vm - b), где b – объём, занимаемый самими молекулами. Объём b равен учетверённому собственному объёму молекул.
Vm – молярный объём.


видно, что для центров 2-х молекул (1 и 2) оказывается недоступными сферический объём, равный восьми объёмам молекул
|
|
|
(V ~ d3 → 23 = 8), что в расчёте на одну молекулу даёт 4.
2) учёт притяжения молекул.
Действие сил притяжения между молекулами газа приводит
к появлению дополнительного давления на газ, называемого внутренним давлением. По расчётам Ван-дер-Ваальса внутреннее давление

где a – постоянная Ван-дер-Вальса, характеризующая силы молекулярного притяжения.
Вводя эти поправки получаем для 1 моля газа
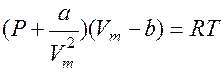 уравнение Ван-дер-Вальса.
уравнение Ван-дер-Вальса.
для количества вещества ν
V = νVm
Эти уравнения приближенные, хотя и лучше согласуются с опытом (особенно для несильно сжатых газов), чем уравнение состояния идеального газа.


Тк – критическая температура.
При высоких Т эта изотерма отличается от изотермы идеального газа только некоторым искажением (монотонно спадает). При Т = Тк на изотерме появляется одна точка перегиба (критическая изотерма, Тк – критическая точка). Соответствующие Тк, давление Рк и объём Vk называется критическими.

|
|


|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 757; Нарушение авторских прав?; Мы поможем в написании вашей работы!