
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм хим реакции
|
|
|
|
Механизм – подробная картина, раскрывающая какие частицы и в какой последовательности и каким образом реагируют между собой, образовывая продукты. Бывают: 1. простые и 2. Сложные.
1. простые (элементарные). – одностадийные, т.е. осуществляются за однократное столкновение.
Молекулярность – число частиц, одновременно сталкивающихся в простой реакции.
- одномолекулярные (моно-…)AgBr à Ag + ½ Br2
- двумалекулярные (би-…) 2HI à H2 +I2
- трехмалекулярные (три-…) 2NO+O2 à 2NO2
- четырехмалекулярные пока не обнаружено
υАА+υВВ→υсС+υДД
nА= υА ; nВ=υВ; n=nА+nВ (молекулярность 1,2,3)
υ=К*САυA*CBυB - з-н действ масс
З-н дм позволяет легко оценить влияние разл факторов на V
2. Сложные - совокупность 2х и более простых реакций.
Виды:
- последовательные 1®2®3®4 (ступенчатая диссоциация и гидролиз); - параллельные (главная – самая быстрая); - цепные (с учетом радикалов); - циклические; - каталитические; - фотозимические 2H2O à(hυ+катализатор) 2H2 + O2;
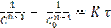 - уравнение для любого «n»
- уравнение для любого «n»
Если сумма стехиометрич коэф υА+υВ>3-сложная, υА+υВ <3-простая
Факторы, определяющие V: Механизм, природа реагентов, Среагентов, t, катализ, проч условия.
Основной з-н хим кинетики – Vхим реакции прямо пропорциональна произведению концентраций реагентов, взятых в некой степени. υАА+υВВ→υсС+υДД
υ=К*САnA*CBnB- ур-ие скорости
СА, CB- концентрация, моль/л
К- const скорости, К=υ при Сi=1 моль/л
nА, nВ- частные порядки; n=nА+nВ- общий порядок
Порядок реакции - формальная величина, может принимать любые значения в зависимости от механизма процесса. Порядок реакции по виду ур-ия невозможно, нужен эксперемент, кроме случаев простых реакций. Принимает любые значения- 0,1,2,3…, дробные, “-”,…,100-1000…
|
|
|
21. Еа. Р-ии между какими частицами идут с заметной V при НУ, какие р-ции требуют инициирования?
Энергия Активации – средняя избыточная энергия, которой должны обладать частицы, чтобы произошла реакция (Еактивации, кДж). Потенциальный барьер, разделяющий исходное и конечное состояние системы, которыйдолжны преодолеть реагирующите частицы, чтобы произошла реакция.
Она тратится н а:
· Преодоление сил, отталкивающих при сближении частиц (электронные облака отталкиваются)
· Разрушение старых связей
· Изменение электронной конфигурации реагентов
Реакция идет: Е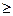 Еактивации
Еактивации
Чем больше Еактивации, тем меньше V химической реакции, так как меньше будет активных частиц, способных вступить во взаимодействие.
Зависимость Еактивации от природы реагентов:
1. если Еа < 100 кДж/моль, то такие реакции относятся к быстрым – они с заметной скоростью протекают уже при стандартных условиях. К ним относятся реакции, с участием свободных атомов, противоположно заряженных ионов, радикалов, а также реакции между самыми активными Ме и НеМе.
2. если Еа >=100 кДж/моль, то такие реакции или не идут, или с очень медленно. Они требуют инициирования (активирования, т.е создания в системе активных частиц –активных молекул, атомов, радикалов, ионов)
методы инициирования:
1. термическое
2. фотохимическое (h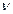 - облучая систему, создаем в ней акт. частицы)
- облучая систему, создаем в ней акт. частицы)
3. радиационно- химический (энергия в сист подается потоком частиц с высокой энергией – нейтроны, протоны и т.п)
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 448; Нарушение авторских прав?; Мы поможем в написании вашей работы!