
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы электродов (I рода (Ме и НеМе); газовые электроды (водородный и кислородный); ок-вос электроды). Ур-ние Нернста для электрод потенциала. Стандарт водородный электрод как
|
|
|
|
Окислительно-восстановительная двойственность на примере Н2О2 и NaNO2.
Ур-ия ок-восст р-ций. Метод электронного баланса. Пр влияния среды (рН) на ок- восст превращ.
ОВР-реакции, которые сопровождаются изменением степени окисления реагентов в результате полного и частичного переноса эл. плотности.
ОВР делятся на типы: 1. Межмолекулярные р-ции – в которых окисилит и восстанов представляют собой разные вещества. Cu+2FeCl3→CuCl2+2FeCl2
1) определяем окисл. и вос. среди исходных вещей; 2)предполагаем вариант изменения их степени ок. в р-ции ОВР; 3) составляем баланс, записываем электродные потенциалы, определяем возможность протекания р-ции; 4) если р-ция возможна, то записываем ур-ние.
2. Внутримолекулярные реакции – окислит и восстан служат атомы или ионы одной и той же молекулы. (NH4)2Cr2O7→N2+Cr2O3+4H2O
3. Р-ции диспропорционирования протекают с одновременным ↓и ↑степ окисл-я атомов одного и того же эл-та. Cl2+H2O→HCl+HClO
При составлении ОВР применяют Метод электронного баланса: Ок-е и восстан-е выражают электронными ур-ми, в которых указывают изменение степени окисления атома восст-ля и окислителя, а также число отданных и принятых электронов. Коэффиц-ты подбираются так, чтобы соблюдался баланс отданных и принятых электронов.
pH среда создается добавлением в ур-ние р-ции молекул к-ты, воды или оснований.
Среда может ослабить окислит-восст св-ва соединений, а иногда изменить направление процесса. Реакция As2O3+2I2+2H2O→As2O5+4HI в прямом направлении идет только в нейтральной и щелочной средах. Чем меньше кислотность среды, тем, как правило, менее глубоко идет процесс: перманганат восстанавливается до Mn2+ в кислой среде, до MnO2 - в нейтральной и до MnO42- в щелочной среде.
|
|
|
Ок.-вос. двойственность –способность одного и того же в-ва, в зависимости от реагентов и от условий проведения реакц, выступать как в роли окислителя, так и в роли восстановителя. В таких в-вах содержится эл-т в промежуточной степ окисл. Ок.-вос. двойственнос характерна для простых в-тв-НемМе.
H2O2+2KI+H2S O4→ I2+2H2O+ K2SO4, 2I(-) -2e→I2(0) в-ль, 2O (-)+2e→2O2(-2) о-ль. H2 O2 окисл., I(+1)- только восст. Eовр=Eок. Eвос.=(см.табл.)=1,77-0,54> 0 1.→2.
5Na N O2+2K Mn O4+3H2SO4разб.→2MnSO4+5NaNO3+K2SO4+3H2O, Eовр=1,51-0.94>0. 1.→2.
восст(+3) только ок.(+7). Mn(+7) +5e→Mn(+2).о-ль N(+3) -2e→N(+5) в-ль
36. Электрохимические процессы. Двойной электрич слой на границе электрод/электролит.
Электрохимические процессы – это процессы взаимного поглощения 2ух форм энергии: хим.и электр. Электродный потенциал-разность электростатич. потенциалов между электродом и находящимся с ним в контакте электролитом; возникает на границе раздела фаз в условиях протекания равновесной электр. р-ции. Э.п. зависит от хим.природы электрода и электролита, концентрации веществ, участвующих в электр.р-ции; температуры. Э. п. равен эдс электрохим. цепи, составленной из исследуемого и стандартного электродов.
Для водных р-ров в качествестандартного электрода обычно используют водородный электрод, С(H+)=1моль/л, р(H2)=1атм. E(H2)=0! Если исследуемый электрод находится в стандартных условиях, когда активности всех ионов, определяющих Э. п., равны 1, а давление газа (для газовых электродов) равно 0,101 МПа, значение Э. п. наз. стандартным (обозначение E °) E°(ок/вос) – стандартный Э.п. при Cок. и Свос. = 1 моль/л. (относительный). Оно связано со стандартным изменением энергии Гиббса ∆G и константой равновесия К рэлектрохим. р-ции ур-нием: -∆G=nFE°=RTlnKp, где F - число Фарадея; п - число электронов, участвующих в р-ции; R - газовая постоянная; Т - абс. т-ра. Зависимость Э. п. от термодинамич. активностей ai участников электрохим. р-ции выражается Нернста уравнение: E=E°(ок/вос)+RT/zF x ln(Cок./Свос.).
|
|
|
Электрод – электронный проводник, нах в контакте с ионным проводником. При погружении Me (НеMe) в р-р электролита на границе раздела фаз возникает скачок потенциала который назыв электродным потенц
Классификация электродов:1-ого рода, 2-ого, ок-вос, ионно-селективные, газовые.
1) Эл. 1-ого рода это Ме или неМе погруженный в р-р собственной соли. Обменивается с электролитом только с катионом или только с анионом.
а) Me электрод: (восс)Zn0|Zn+2SO4(окис) Zn+2+2e→Zn0
Ур-ие Нернста для Me: EZn2+/Zn0=E0Zn2+/Zn0+(RT/ZF)Ln(Cок(Zn2+)/Cвос(Znтв))
EZn/Zn2+=-0,76+(0,0256/2)LnC(Zn2+)
Для Ме-кого электрода: EMeZ+/Me=E0MeZ+/Me+(RT/ZF)LnC(MeZ+)
б) НеМе электрод: (окис)Pt,S|K2S-2 (восс)(чтоб помочь S отдать ел. дописываем Pt, но сам Pt в р-ци не участ)
S0+2e→S-2 ES0/S-2=E0S0/S2++(RT/ZF)Ln(C(Sтв)/C(S-2)); ES0/S-2=-0,46-(0,0256/2)LnC(S2-)
Ур-ние Нернста для НеМе: EA0/AZ-=E0A0/AZ--(RT/ZT)LnC(AZ-)
2)Окислительно-восстановительные электроды- это инертный(пассивный) Ме (Pt),погруженный в р-р электролита содержащий и окислительную и восстановительную форму вещества.
Pt|окис,восс Pt|, Fe2+3(O4)3, Fe+2SO4 Fe3++e→Fe2+
EFe3+/Fe2+=E0Fe3+/Fe2++(RT/ZF)Ln(C(Fe3+)/C(Fe2+))
3 )газовые электроды - это инертный Ме (Pt), находящийся в контакте с газом и погруженный р-р, содержащий ион данного газообразного вещества.
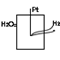 Водородный электрод EH2 =0 Pt, H2/H+Cl
Водородный электрод EH2 =0 Pt, H2/H+Cl
P H2=1 атмосфера
2H++2e→H2
EH2=E0+(RT/2P)Ln(C2(H+)/P H2) Учитывая, что E0H2=0
EH2=-0,059pH lgC (H+)=pH ln=2,3Lg
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 523; Нарушение авторских прав?; Мы поможем в написании вашей работы!