
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные характеристики химической связи. Химическая связь является двухэлектронной
|
|
|
|
Химическая связь является двухэлектронной. Электроны, участвующие в образовании химической связи, имеют противоположные спины и образуют общую электронную пару.
МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ
Различают обменный и донорно-акцепторный механизмы образования химической связи:
1) Обменный – два атома предоставляют по одному электрону на образование общей электронной пары.
Например, образование молекул Н2 и НСl:
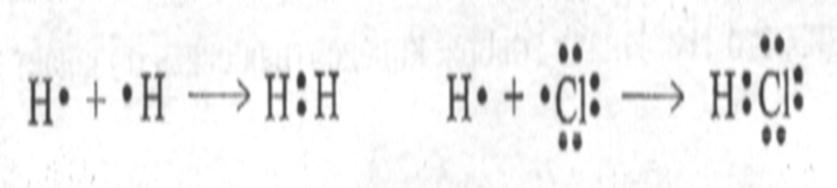
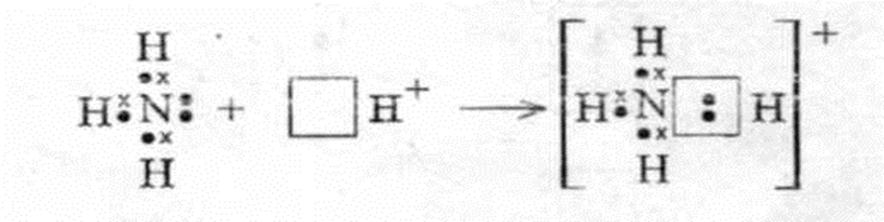
2) Донорно-акцепторный –
донор – предоставляет электронную пару,
акцептор – свободную орбиталь.
Например, взаимодействие NН3 с ионом Н+ с образованием катиона аммония NН4+
По способу перекрывания электронных облаков связи делят на σ-связь и π- связь:
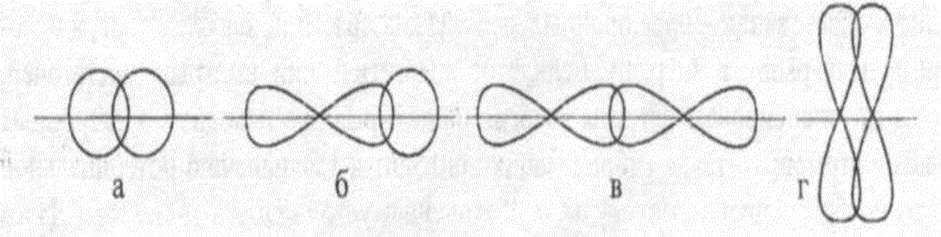
1) σ-связь – перекрывания электронных облаков по прямой линии, соединяющей центры атомов.2) π -связь – выше и ниже данной линии.
σ-связь является более прочной чем π-связь.
Энергия связи – это энергия, необходимая для разрыва химической связи. Энергии разрыва и образовании связи равны по величине но противоположны по знаку. Чем больше энергия химической связи, тем устойчивее молекула. Обычно энергию связи измеряют в кДж/моль.
Для многоатомных соединений с однотипными связями за энергию связи принимается среднее ее значение, рассчитанное делением энергии образования соединения из атомов на число связей. Так, на разрыв связи H–H затрачивается 432,1 кДж/моль, а на разрыв четырех связей в молекуле метана CH4 – 1648 кДж/∙моль и в этом случае EC–H = 1648: 4 = 412 кДж/моль.
Длина связи – это расстоянию между ядрами взаимодействующих атомов в молекуле. Она зависит от размеров электронных оболочек и степени их перекрывания.
|
|
|
Полярность связи – это распределение электрического заряда между атомами в молекуле.
Если электроотрицательности атомов, участвовавших в образовании связи одинаковы, то связь будет неполярная, а в случае разных электроотрицательностей – полярной. Крайний случай полярной связи, когда общая электронная пара практически полностью смещена к более электроотрицательному элементу, приводит к ионной связи.
Например: Н–Н – неполярная, Н–Сl – полярная и Nа+–Сl- – ионная.
Следует различать полярности отдельных связей и полярность молекулы в целом.
Полярность молекулы – это векторная сумма дипольных моментов всех связей молекулы.
Например:
1) Линейная молекула CO2 (О=С=О) неполярна –дипольные моменты полярных связей С=О компенсируют друг друга.
2)Молекула воды полярна – дипольные моменты двух связей О—Н не компенсируют друг друга.
Пространственное строение молекул определяется формой и расположением в пространстве электронных облаков.
Порядок связи – это число химических связей между двумя атомами.
Например, порядок связи в молекулах H2, O2 и N2 равен соответственно 1, 2 и 3, поскольку связь в этих случаях образуется за счёт перекрывания одной, двух и трех пар электронных облаков.
4. ТИПЫ ХИМИЧЕСКИХ СВЯЗЕЙ
4.1. Ковалентная связь – это связь между двумя атомами посредством общей электронной пары.
Количество химических связей определяется валентностями элементов. Валентность элемента – число орбиталей, принимающих участие в образовании связей. Ковалентная неполярная связь - эта связь, осуществляемая за счет образования электронных пар между атомами с равной электроотрицательностью. Например, Н2, О2, N2, Cl2 и т. д. Ковалентная полярная связь – эта связь между атомами с различной электроотрицательностью. Например, НCl, H2S, PH3 и т.д. Ковалентная связь обладает свойствами: 1) Насыщаемости – способностью атома образовывать столько связей, сколько у него имеется валентностей. 2) Направленности – перекрытие электронных облаков происходит в направлении обеспечивающем максимальную плотность перекрытия. Это крайний случай ковалентной полярной связи и возникает при большой разнице в электроотрицательностях взаимодействующих атомов. Иoннaя связь не обладает направленностью и насыщаемостью. Степень окисления – это условный заряд атома в соединении исходя из предположения, что происходит полная ионизация связей.
 4.2. Ионная связь – это связь между противоположно заряженными ионами.
4.2. Ионная связь – это связь между противоположно заряженными ионами.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 512; Нарушение авторских прав?; Мы поможем в написании вашей работы!