
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 8. Галогены. Свойства элементов VII A группы
|
|
|
|
Физические свойства. Серная кислота — тяжелая бесцветная маслянистая жидкость. Крайне гигроскопична. Поглощает влагу с выделением большого количества теплоты, поэтомунельзя воду приливать к концентрированной кислоте — произойдет разбрызгивание кислоты. Для разбавления надосерную кислоту приливать небольшими количествами к воде.
Сера
Свойства 16S.
| Атомная масса | 32,06 | кларк, ат.% (распространненость в природе) | 0,03 |
| Электронная конфигурация* | 
| Агрегатное состояние (н. у.). | твердое вещество |
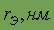
| 0,127 | Цвет | желтый |

| (0,029) | 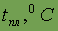
| 119,30 |
Энергия ионизации
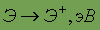
| 10,357 | 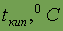
| 444,6 |
| Относительная электроотрицательность | 2,5 | Плотность 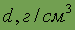
| 2,07 |
| Возможные степени окисления | -2,+1,+2, +3, +4,+6 | Стандартный электродный потенциал

| - 0,44 |
*Приведена конфигурация внешних электронных уровней атома элемента. Конфигурация остальных электронных уровней совпадает с таковой для благородного газа, завершающего предыдущий период и указанного в скобках.
Нахождение в природе. Сера широко распространена в природе. Она составляет 0,05% массы земной коры. В свободном состоянии (самородная сера) в больших количествах встречается в Италии (острова Сицилия) и США. Месторождения самородной серы имеются в Поволжье, в государствах Средней Азии, в Крыму и других районах.
Сера часто встречается в виде соединений с другими элементами. Важнейшими ее природными соединениями являются сульфиды металлов: FeS2 — железный колчедан, или пирит; ZnS — цинковая обманка; PbS — свинцовый блеск; HgS — киноварь и др., атакжесоли серной кислоты (кристаллогидраты): СаSO4 2Н2O — гипс, Na2SO4 10H2O — глауберова соль, МgSО4 7H2O — горькая соль и др.
|
|
|
Сера содержится в организмах животных и растений, так как входит в состав белковых молекул. Органические соединения серы содержатся в нефти.
Физические свойства. Сера — твердое хрупкое вещество желтого цвета. В воде практически нерастворима, но хорошо растворяется в сероуглероде, анилине и некоторых других растворителях. Плохо проводит теплоту и электричество. Сера образует несколько аллотропных модификаций — сера ромбическая, моноклинная, пластическая. Наиболее устойчивой модификацией является ромбическая сера, в нее самопроизвольно через некоторое время превращаются все остальные модификации.
При 444,6 °С сера кипит, образуя пары темно-бурого цвета. Если их быстро охладить, то получается тонкий порошок, состоящий из мельчайших кристаллов серы, называемый серным цветом.
Природная сера состоит из смеси четырех устойчивых изотопов: 
Химические свойства. Сера может отдавать свои электроны при взаимодействии с более сильными окислителями:

В этих реакциях сера является восстановителем. Нужно подчеркнуть, что оксид серы (VI) может образовываться только в присутствии Pt или V2O5 и высоком давлении.
При взаимодействии с металлами сера проявляет окислительные свойства:
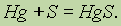
С большинством металлов сера реагирует при нагревании, но в реакции со ртутью взаимодействие происходит уже при комнатной температуре. Это обстоятельство используется в лабораториях для удаления разлитой ртути, пары которой являются сильным ядом.
Применение. Сера широко применяется в промышленности и сельском хозяйстве. Около половины ее добычи расходуется для получения серной кислоты. Используют серу для вулканизации каучука: каучук приобретает повышенную прочность и упругость. В виде серного цвета (тонкого порошка) сера применяется для борьбы с болезнями виноградника и хлопчатника. Она употребляется для получения пороха, спичек, светящихся составов. В медицине приготовляют, серные мази для лечения кожных заболеваний.
|
|
|
Сероводород, сероводородная кислота, сульфиды. При нагревании серы с водородом происходит обратимая реакция:

с очень малым выходом сероводорода H2S. Обычно Н2S получают действием разбавленных кислот на сульфиды:

Эту реакцию часто проводят в аппарате Киппа.
Физические свойства. Сероводород Н2S — бесцветный газ с запахом тухлых яиц, ядовит. Один объем воды при обычных условиях растворяет 3 объема сероводорода.Сероводород — очень ядовитый газ, поражающий нервную систему. Поэтому работать с ним надо в вытяжных шкафах или с герметически закрывающимися приборами. Допустимое содержание H2S в производственных помещениях составляет 0,01 мг в 1 л воздуха.
Раствор сероводорода а воде называется сероводородной водой или сероводородной кислотой (она обнаруживает свойства слабой кислоты).
Химические свойства. Сероводород — типичный восстановитель. В кислороде он сгорает. Раствор сероводорода в воде представляет собой очень слабую сероводородную кислоту, которая диссоциирует ступенчато и в основном по первой ступени:

Сероводородная кислота, так же как и сероводород, — типичный восстановитель.
Сероводородная кислота окисляется не только сильными окислителями, например хлором,

но и более слабыми, например сернистой кислотой H2SO3:

или ионами трехвалентного железа:

Сероводородная кислота может реагировать с основаниями, основными оксидами или солями, образуя два ряда солей: средние — сульфиды, кислые — гидросулъфиды. Большинство сульфидов (за исключением сульфидов щелочных и щелочноземельных металлов, а также сульфида аммония) плохо растворимо в воде. Сульфиды,каксоли очень слабой кислоты, подвергаются гидролизу.
Нахождение в природе. Сероводород встречается в природе в вулканических газах и В водах некоторых минеральных источников, например Пятигорска, Мацесты. Он образуется при гниении серосодержащих органических веществ различных растительных и животных остатков. Этим объясняется характерный неприятный запах сточных вод, выгребных ям и свалок мусора.
Сульфиды. Например, Na2S — сульфид натрия, NaHS — гидросульфид натрия.
Гидросульфиды почти все хорошо растворимы в воде. Сульфиды щелочных и щелочно-земельных металлов также растворимы в воде, а остальных металлов практически нерастворимы или мало растворимы; некоторые из них не растворяются и в разбавленных кислотах. Поэтому такие сульфиды можно легко получить, пропускаясероводород через соли соответствующего металла, например:
|
|
|

Некоторые сульфиды имеют характерную окраску: CuS и PbS — черную, CdS — желтую, ZnS — белую, MnS — розовую, SnS — коричневую, Sb2S3 — оранжевую и т. д. На различной растворимоcти сульфидов и различной окраске многих из них основан качественный анализ катионов.
Оксид серы (IV). Оксид серы (IV), или сернистый газ, при обычных условиях — бесцветный газ с резким, удушливым запахом. При охлаждении до -10° С сжижается в бесцветную жидкость. В жидком виде его хранят в стальных баллонах.
SO2 образуется при сжигании серы в кислороде или при обжиге сульфидов. Он хорошо растворим в воде (40 объемов в 1 объеме воды при 20 °С).
Получение. В лаборатории оксид серы (IV) получают взаимодействием гидросульфита натрия с серной кислотой:
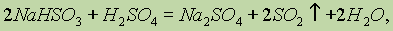
а также нагреванием меди с концентрированной серной кислотой:
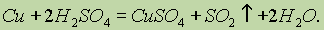
Оксид серы (IV) образуется также при сжигании серы.
В промышленных условиях SO2 получают при обжиге пирита FeS2 или сернистых руд цветных металлов (цинковой обманки ZnS, свинцового блеска PbS и др.). Образующийся в этих условиях оксид серы (IV) SO2 употребляется главным образом для получения оксида серы (VI) SO3 и серной кислоты. Структурная формула молекулы SO2:

Как видим, в образовании связей в молекуле SO2 принимают участие четыре электрона серы и четыре электрона от двух атомов кислорода. Взаимное отталкивание связывающих электронных пар и неподеленной электронной пары атома серы придает молекуле угловую форму.
Оксид серы (IV) проявляет все свойства кислотных оксидов.
Сернистая кислота. Оксид серы (IV) — ангидрид сернистой кислоты H2SO3 , поэтому при растворении SO2 в воде частично происходит реакция с водой и образуется слабая сернистая кислота:

которая малоустойчива, легко распадается вновь на SO2 и Н2О. В водном растворе сернистого газа одновременно существуют следующие равновесия:
|
|
|

Константа диссоциации H2SO3 по первой ступени равна K1 = 1,6 10-2, по второй — K2 = 6,3 10-8. Являясь двухосновной кислотой, она дает два ряда солей: средние — сульфиты и кислые — гидросульфиты.
Сульфиты образуются при полной нейтрализации кислоты щелочью:

Гидросульфиты получаются при недостатке щелочи (по сравнению с количеством, необходимым для полной нейтрализации кислоты):

Как и оксид серы (IV), сернистая кислота и ее соли являются сильными восстановителями. При этом степень окисления серы возрастает. Так, H2SO3 легко окисляется в серную кислоту даже кислородом воздуха:

Поэтому долго хранившиеся растворы сернистой кислоты всегда содержат серную кислоту.
Еще легче протекает окисление сернистой кислоты бромом и перманганатом калия:

Химические реакции, характерные для SO2, сернистой кислоты и ее солей, можно разделить на три группы:
1. Реакции, протекающие без изменения степени окисления, например:
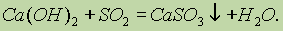
2. Реакции, сопровождающиеся повышением степени окисления серы от 4+ до 6+:

3. Реакции, протекающие с понижением степени окисления серы, например уже отмеченное выше взаимодействие SO2 с H2S.
Таким образом, SO2, сернистая кислота и ее соли могут проявлять как окислительные, так и восстановительные свойства.
Применение. Оксид серы (IV) и сернистая кислота обесцвечивают многие красители, образуя с ними бесцветные соединения. Последние могут снова разлагаться при нагревании или на свету, в результате чего окраска восстанавливается. Следовательно, белящее действие SO2 и H2SO3 отличается от белящего действия хлора. Обычно оксидом серы (IV) белят шерсть, шелк и солому (хлорной водой эти материалы разрушаются).
Оксид серы (IV) убивает многие микроорганизмы. Поэтому для уничтожения плесневых грибков им окуривают сырые подвалы, погреба, винные бочки и др. Используют также при перевозке и хранении фруктов и ягод. В больших количествах оксид серы (IV) используется для получения серной кислоты.
Важное применение находит раствор гидросульфита кальция Са(НSO3)2 (сульфитный щелок), которым обрабатывают волокна древесины и бумажную массу.
Оксид серы (VI). SO3 — ангидрид серной кислоты — вещество с tпл= 16,8 °С и tкип= 44,8 °С. Оксид серы (VI), или триоксид серы, — это бесцветная жидкость, затвердевающая при температуре ниже 17° С в твердую кристаллическую массу. Оксид серы (VI) обладает всеми свойствами кислотных оксидов. Он является промежуточным продуктом производства серной кислоты.
Оксид серы (VI) получают окислением SO2 кислородом только в присутствии катализатора:

Необходимость использования катализатора в этой обратимой реакции обусловлена тем, что хороший выход SO3 (т. е. смещение равновесия вправо) можно получить только при понижении температуры, однако при низких температурах очень сильно падает скорость протекания реакции.
Молекула SO3 имеет форму треугольника, в центре которого находится атом серы:

Такое строение обусловлено взаимным отталкиванием связывающих электронных пар. На их образование атом серы предоставил все шесть внешних электронов.
Серная кислота. Оксид серы (VI) энергично соединяется с водой, образуя серную кислоту:
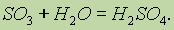
SO3 очень хорошо растворяется в 100%-ной серной кислоте. Раствор 80з в такой кислоте называется олеумом.
Безводная серная кислота растворяет до 70% оксида серы (VI). При обычной температуре она не летуча и не имеет запаха. При нагревании отщепляет SO3 до тех пор, пока не образуется раствор, содержащий 98,3% Н2SO4. Безводная Н2SO4 почти не проводит электрический ток.
Химические свойства. Концентрированная серная кислота обугливает органические вещества — сахар, бумагу, дерево, волокна и т. д., отнимая от них элементы воды. При этом образуются гидраты серной кислоты. Обугливание сахара можно выразить уравнением
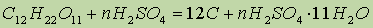
Образовавшийся уголь частично вступает во взаимодействие с кислотой:

Поэтому кислота, которая идет в продажу, имеет бурый цвет от случайно попавших и обуглившихся в ней пыли и органических веществ.
На поглощении (отнятии) воды серной кислотой основана осушка газов.
Как сильная нелетучая кислота H2SO4 вытесняет другие кислоты из сухих солей:

Однако если Н2SO4 добавляется к растворам солей, то вытеснения кислот не происходит.
При взаимодействии концентрированной серной кислоты с различными металлами, как правило, происходит ее восстановление до SO2:

Концентрированная серная кислота окисляет медь, серебро, углерод, фосфор:

Разбавленная серная кислота окисляет только металлы, стоящие в ряду напряжений левее водорода, за счет ионов Н+:

Из всех сульфатов наименьшей растворимостью обладает сульфат бария — именно поэтому его образование в виде белого осадка используют как качественную реакцию на сульфат-ион:
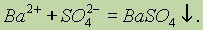
Значение серной кислоты. Серная кислота является важнейшим продуктом основной химической промышленности, занимающейся производством неорганических кислот, щелочей, солей минеральных удобрений и хлора.
По разнообразию применения серная кислота занимает первое место среди кислот. Наибольшее количество ее расходуется для получения фосфорных и азотных удобрений. Будучи нелетучей кислотой, серная кислота используется для получения других кислот — соляной, плавиковой, фосфорной, уксусной и т. д. Много ее идет для очистки нефтепродуктов — бензина, керосина и смазочных масел — от вредных примесей. В машиностроении серной кислотой очищают поверхность металла от оксидов перед покрытием (никелированием, хромированием и др.). Серная кислота применяется в производстве взрывчатых веществ, искусственного волокна, красителей, пластмасс и многих других. Ее употребляют для заливки аккумуляторов. В сельском хозяйстве она используется для борьбы с сорняками (гербицид).
Соли серной кислоты. Серная кислота, будучи двухосновной, образует два ряда солей: средние, называемые сульфатами, и кислые, называемые гидросульфатами. Сульфаты образуются при полной нейтрализации кислоты щелочью (на один моль кислоты приходится два моля щелочи), а гидросульфаты — при недостатке щелочи (на один моль кислоты — один моль щелочи):
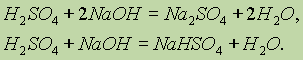
Многие соли серной кислоты имеют большое практическое значение.
1. Общая характеристика
2. Получение
3. Физические свойства
4. Химические свойства
5. Соединения
| Свойства | 9F | 17Cl | 35Br | 53I | 85At |
| Атомная масса | 18,998 | 35,453 | 79,909 | 126,904 | [210] |
| Электронная конфигурация* | 
| 
| 
| 
| 
|
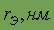
| 0,071 | 0,99 | 0,114 | 0,133 | - |

| 0,133 | 0,181 | 0,196 | 0,220 | 0,230 |
Энергия ионизации
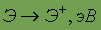
| 17,43 | 13,01 | 11,84 | 10,45 | 9,50 |
| Относительная электроотри- цательность | 4,00 | 3,00 | 2,80 | 2,60 | 2,20 |
| Возможные степени окисления | -1 | -1, +1, +3, +5, +7 | |||
| кларк, ат.% (распространненость в природе) | 0,02 | 0,02 | 3*10-5 | 4*10-6 | следы |
| Агрегатное состояние (н. у.), цвет | газ сетло-зеленый | газ желто-зеленый | жидкость красно-коричневая | тв. вещество черно-фиолетовое | тв. вещество |
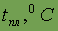
| -223 | -100,98 | -7,2 | 311,5 | |
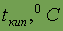
| -187 | -34,5 | 58,75 | 184,5 | |
Плотность 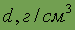
| 1,108 ж. | 1,57 ж. | 3,187 | 4,942 | - |
Стандартный электродный потенциал

| 2,87 | 1,36 | 1,07 | 0,54 | - |
*Приведены конфигурации внешних электронных уровней атомов соответствующих элементов. Конфигурации остальных электронных уровней совпадают с таковыми для благородных газов, завершающих предыдущий период и указанных в скобках.
Электронные конфигурации внешнего валентного слоя галогенов относятся к типу ns2np5 (n == 2, 3, 4 и 5 соответственно у фтора, хлора, брома и иода). Такие электронные конфигурации обусловливают типичные окислительные свойства галогенов — способностью присоединять электроны обладают все галогены, хотя при переходе к иоду окислительная способность галогенов ослабляется.
При обычных условиях галогены существуют в виде простых веществ, состоящих из двухатомных молекул типа Hal2 с ковалентными связями.
Физические свойства галогенов существенно различаются: при нормальных условиях фтор — газ, который трудно сжижается, хлор — также газ, но сжижается легко, бром — жидкость, иод — твердое вещество.
Химические свойства. В отличие от всех других галогенов фтор во всех своих соединениях проявляет только одну степень окисления 1- и не проявляет переменной валентности. Для других галогенов наиболее характерной степенью окисления также является 1-, однако, благодаря наличию свободных d-орбиталей на внешнем уровне они могут проявлять и другие нечетные степени окисления от 1+ до 7+ за счет частичного или полного распаривания валентных электронов.
Наибольшей активностью обладает фтор. Большинство металлов даже при комнатной температуре загорается в его атмосфере, выделяя большое количество теплоты, например:

Без нагревания фтор реагирует и со многими неметаллами (водородом, S, С, Si, P), выделяя при этом также большое количество теплоты:

При нагревании фтор окисляет все другие галогеныпо схеме:
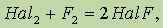
где Hal = Cl, Br, I, причем в соединениях HalF степени окисления хлора, брома и иода равны 1+.
Наконец, при облучении фтор реагирует даже с инертными газами:

Взаимодействие фтора со сложными веществами также протекает очень энергично. Он окисляет воду, при этом реакция носит взрывной характер:

Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов, например:

Для этих реакций, как и для всех других, очень важны условия их протекания. Так, при комнатной температуре хлор с водородом не реагирует; при нагревании эта реакция протекает, но оказывается сильно обратимой, а при мощном облучении протекает необратимо (со взрывом) по цепному механизму.
Хлор вступает в реакции со многими сложными веществами, например замещения и присоединения с углеводородами:

Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
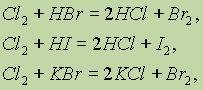
а также обратимо реагирует с водой:
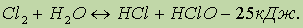
Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой.
Хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала1- (в НС1), у других1+ (в хлорноватистой кислоте НОС1). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования.
Хлор может таким же образом реагировать (диспропорционировать) со щелочами.
Химическая активность брома меньше, чем фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора. Являясь более “мягким” реагентом, бром находит широкое применение в органической химии.
Отметим, что бром, так же как и хлор, растворяется в воде и, частично реагируя с ней, образует так называемую “бромную воду”, тогда как иод практически в воде нерастворим и не способен ее окислять даже при нагревании; по этой причине не существует “йодной воды”.
Получение галогенов. Наиболее распространенным технологическим методом получения фтора и хлора является электролиз расплавов их солей. Бром и иод в промышленности, как правило, получают химическим способом.
В лаборатории хлор получают действием различных окислителей на соляную кислоту, например:

Еще более эффективно окисление проводится перманганатом калия.
Галогеноводороды. Все галогеноводороды при обычных условиях газообразны. Химическая связь, осуществляемаяв их молекулах, — ковалентная полярная, причем полярность связи в ряду HF — НС1 — HBr — HI падает. Прочность связи также уменьшается в этом ряду. Вследствие своей полярности все галогеноводороды, в отличие от галогенов, хорошо растворимы в воде. Так, при комнатной температуре в 1 объеме воды можно растворить около 400 объемов НСl, 530 объемов HBr и около 400 объемов HI.
При растворении галогеноводородов в воде происходит их диссоциация на ионы и образуются растворы соответствующих галогеноводородных кислот. Причем при растворении HI, HBr и НС1 диссоциируют почти полностью, поэтому образующиеся кислоты относятся к числу сильных. В отличие от них фтороводородная (плавиковая) кислота является слабой. Это объясняется ассоциацией молекул HF вследствие возникновения между ними водородных связей. Таким образом, сила кислот уменьшается от HI к НF.
Поскольку отрицательные ионы галогеноводородных кислот могут проявлять только восстановительные свойства, то при взаимодействии этих кислот с металлами окисление последних может происходить только за счет ионов Н+. Поэтому кислоты HHal реагируют только с металлами, стоящими в ряду напряжений левее водорода.
Все галогениды металлов, за исключением солей Ag и РЬ, хорошо растворимы в воде. Малая растворимость галогенидов серебра позволяет использовать обменную реакцию типа

как качественную для обнаружения соответствующих ионов. В результате реакции AgCl выпадает в виде осадка белого цвета, AgBr — желтовато-белого, AgI — ярко-желтого цвета.
В отличие от других галогеноводородных кислот плавиковая кислота взаимодействует с оксидом кремния (IV):
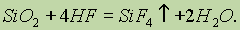
Так как оксид кремния входит в состав стекла, то плавиковая кислота разъедает стекло, и поэтому в лабораториях ее хранят в сосудах из полиэтилена или тефлона.
Кислородсодержащие соединения галогенов. Все галогены, кроме фтора, могут образовывать соединения, в которых они обладают положительной степенью окисления. Наиболее важными из таких соединений являются кислородсодержащие кислоты галогенов типа НСlOn (n = 1— 4) и соответствующие им соли и ангидриды.
Рассмотрим структурные формулы этих кислот:

Хлорноватистая

Хлористая

Хлорноватая

Хлорная
Для диссоциации по кислотному типу необходим разрыв связи О—Н. Как можно объяснить уменьшение прочности этой связи в ряду НСlO — HClO2 — НClO3 — НClO4? В этом ряду увеличивается число атомов кислорода, связанных с центральным атомом хлора. Каждый раз, когда образуется новая связь кислорода с хлором, от атома хлора, а следовательно, и от первичной связи О—С1 оттягивается некоторая доля электронной плотности. В результате этого часть электронной плотности оттягивается и от связи О—Н, которая за счет этого ослабляется.
Такая закономерность — усиление кислотных свойств с возрастанием степени окисления центрального атома — характерна не только для хлора, но и для других элементов. Например, азотная кислота HNO3, в которой степень окисления азота равна 5+, является более сильной кислотой, чем азотистая кислота HNO2 (степень окисления азота 3+); серная кислота H2SO4 (S6+) — более сильная, чем сернистая кислота Н2SО3 (S4+).
Из солей кислородсодержащих кислот хлора наибольшее значение имеют бертолетова соль (хлорат калия) КсlO3 и хлорная (“белильная”) известь. В лабораторной практике КClO3 широко используется для получения О2 (в присутствии MnO2 в качестве катализатора).
Хлорную известь получают действием хлора на гидроксид кальция (“гашеную известь”):

Получаемую смесь называют хлорной известью. Если формально просуммировать состав хлорной извести, то его можно выразить как CaOCl2. Таким образом, хлорная известь представляет собой смешанную соль — хлорид-гипохлорит кальция.
Галогениды. Хлорид натрия (другие названия: каменная соль, поваренная соль, галит) NaCl является приправой к пище, служит сырьем для получения гидроксида натрия, хлора, соляной кислоты, соды и др.; используется для консервирования пищевых продуктов. Хлорид калия КСl — ценное калийное удобрение. Хлорид цинка ZnCl2 используется для пропитки древесины в целях предохранения от гниения; применяется также при паянии для смачивания поверхности металла (устраняет пленку оксида и припой хорошо пристает к металлу); известны кристаллогидраты ZnCl2 nН2О. Хлорид бария BaCl2 — ядовитое вещество, применяемое для борьбы с вредителями сельского хозяйства (свекловичным долгоносиком, луговым мотыльком и др.). Хлорид кальция CaCl2 (безводный) — широко применяется для осушки газов (при этом образуется кристаллогидрат соли СаСl2 6Н2O) и в медицине. Хлорид алюминия АlCl3 (безводный) часто используется как катализатор при органических синтезах. Хлорид ртути (II), или сулема, HgCl2 — сильный яд; очень разбавленные растворы соли применяются как сильнодействующее дезинфицирующее средство; используется также для протравливания семян, дубления кожи, в органическом синтезе. Хлорид серебра AgCl — малорастворимая соль, используется в фотографии.
Лекция 9. Благородные газы. Свойства элементов VIII A группы.
1. Общая характеристика
2. Получение
3. Физические свойства
4. Химические свойства
5. Соединения
| Свойства | 2He | 10Ne | 18Ar | 36Kr | 54Xe | 86Rn |
| Атомная масса | 4,002 | 20,179 | 39,948 | 83,800 | 131,300 | [222] |
| Электронная конфигурация* | 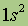
| 
| 
| 
| 
| 
|
| 0,133 | 0,160 | 0,190 | 0,197 | 0,220 | 0,214 |
Энергия ионизации
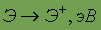
| 24,58 | 21,559 | 15,755 | 13,996 | 12,127 | 10,745 |
| кларк, ат.% (распростран-неность в природе) | 8× 10 7 | 5× 10 7 | 3,5× 10 4 | 1,9× 10 8 | 2,9× 10 9 | 4× 10 17 |
| Агрегатное состояние (н. у.) | Г А З О О Б Р А З Н Ы Е В Е Щ Е С Т В А | |||||
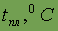
| -272,04 | -248,6 | -189,3 | -157,2 | -111,9 | -71 |
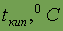
| -268,94 | -246,08 | -185,87 | -153,2 | -108,1 | -65 |
Плотность 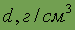
| 0,1785 | 0,901 | 1,784 | 3,744 | 5,896 | 9,96 |
*Приведены конфигурации внешних электронных уровней атомов соответствующих элементов. Конфигурации остальных электронных уровней совпадают с таковыми для благородных газов, завершающих предыдущий период и указанных в скобках.
Атомы благородных газов содержат на внешнем уровне по 8 электронов (у гелия 2). Ранее считалось, что такие атомы не способны ни отдавать электроны, ни принимать их, ни образовывать общие электронные пары.Однако в 1962 г. было получено первое химическое соединение благородного газа – тетерафторид ксенона XeF4, после чего химия благородных газов начала развиваться быстрыми темпами. Особенно богата химия ксенона, соединения которого по свойствам сходны с соответствующими соединениями иода.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1391; Нарушение авторских прав?; Мы поможем в написании вашей работы!