
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электропроводность электролитов в растворах
|
|
|
|
Свойства растворов электролитов
Лекция 8
Электрическая проводимость растворов известна с XVIII в, но долгое время этот факт не воспринимался как доказательство постоянного присутствия в растворе заряженных частиц. Заряды, переносящие электричество, могли возникать и перемещаться под действием приложенной разности потенциалов. Когда С. Аррениус выдвинул теорию электролитической диссоциации (1887), большинство современных ему ученых категорически отвергали существование свободных ионов. В качестве основного аргумента, доказывающего реальность ионов в растворах, Аррениус рассматривал не сам факт электрической проводимости (электропроводности), а характер зависимости проводимости от концентрации электролита.
Рассмотрим основные понятия, относящиеся к электрической проводимости. Непосредственно измеряют электрическое сопротивление раствора электролита в ячейке с платиновыми электродами в виде прямоугольных пластинок со стороной 1 – 2 см. Проводником оказывается раствор между электродами.
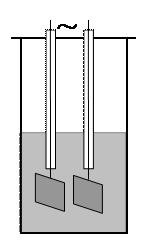
Проводимостью L называется обратная величина электрического сопротивления R. Сопротивление пропорционально удельному сопротивлению проводника ρ и его длине l, и обратно пропорционально площади сечения S. Удельная электрическая проводимость κ численно равна проводимости электролита, заключенного между электродами площадью 1 см2 и находящимися на расстоянии 1 см. Основные формулы:
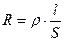 ;
;  ;
; 
Удельная электрическая проводимость зависит от числа ионов в единице объема и их подвижности. Для более наглядной характеристики свойств электролита и сравнения различных электролитов между собой используется эквивалентная электропроводность 000, определяемая как отношение удельной электропроводности к молярной концентрации эквивалента:
|
|
|

Множитель 1000 см3·л–1 введен в формулу в связи с тем, что концентрация выражается в моль/л. Единица измерения эквивалентной электропроводности Ом–1·см2·моль–1. Физический смысл Λ можно уяснить следующим образом: это проводимость объема раствора, в котором заключено количество электролита, способное образовать ионы с суммарным зарядом F как для положительных, так и для отрицательных ионов; при этом весь раствор находится между пластинами электродов, имеющих необходимую площадь и с расстоянием между ними 1 см. При уменьшении концентрации мы должны представить себе увеличичение площадь электродов, так что между ними по прежнему находится 1 моль-экв электролита.
Эквивалентная электропроводность тоже зависит от концентрации электролита по двум главным причинам: 1) Притяжение между ионами тормозит их движение в электрическом поле, вызывая кажущееся уменьшение концентрации. При сильном («бесконечном») разбавлении раствора действие этого эффекта ослабевает, и эквивалентная электропроводность постепенно приближается к максимальному значению Λ∞. 2) Некоторая доля электролита может находиться в растворе в молекулярном состоянии, в результате чего реальное количество ионов резко уменьшается, и электропроводность оказывается ниже, чем при распаде всех молекул. При разбавлении раствора равновесие смещается в направлении образования ионов, и эквивалентная электропроводность также приближается к максимальному значению Λ∞. В эквивалентную электропроводность дают свой вклад как катионы, так и анионы в соответствии с их подвижностью. Максимальная электрическая проводимость электролита вычисляется по закону Кольрауша как сумма предельных молярных электрических проводимостей катионов и анионов, λ+ и λ–:
|
|
|
Λ∞ = λ+ + λ–
Предельные молярные электрические
проводимости некоторых ионов (25ºС)
| λ+, Ом–1·см2·моль–1 | λ–, Ом–1·см2·моль–1 | ||
| H+ | 349,65 | OH– | |
| Li+ | 38,7 | F– | 55,4 |
| Na+ | 50,1 | Cl– | 73,3 |
| K+ | 73,5 | Br– | 78,1 |
| NH4+ | 73,5 | 1/2SO24– | 80,0 |
| 1/2Mg2+ | 53,0 | NO3– | 71,4 |
| 1/2Ca2+ | 59,5 | 1/2CO32– | 69,3 |
| 1/3Al3+ | CH3COO– | 40,9 | |
| 1/2Fe2+ | HCO3– |
Среди данных таблицы обращают на себя внимание высокие значения 000 ионов H+ и OH–. Особая подвижность этих ионов объясняется эстафетным механизмом проводимости, когда движется в электрическом поле не ион как таковой (H3O+ и OH–), а протон, необычайно быстро перемещающийся от одной частицы к другой.
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 335; Нарушение авторских прав?; Мы поможем в написании вашей работы!