
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сила кислот и оснований
|
|
|
|
Вспомним, что в теории Аррениуса сила кислот характеризуется константами диссоциации. В протолитической теории константы диссоциации не имеют смысла, так как молекула НВ не может просто распадаться на протон Н+ и основание В–. Протон должен быть передан другой молекуле. Разные кислоты по силе следует сравнивать в одной и той же среде, в качестве которой логично взять воду. Поэтому сила кислоты оценивается относительно стандартной кислоты, сопряженной воде – гидроксония H3O+. Напишем гипотетические реакции отдачи протона какой-либо кислотой и гидроксонием:
 НВ В– + Н+, K (HB)
НВ В– + Н+, K (HB)
 H3O+ H2O + Н+, K (Н3О+)
H3O+ H2O + Н+, K (Н3О+)
Вычитая вторую реакцию из первой, получим уравнение реакции данной кислоты с растворителем:
 НВ + H2O H3O+ + В–
НВ + H2O H3O+ + В–
При вычитании реакций их константы равновесия делятся одна на другую. Таким образом, константа равновесия этой реакции показывает, во сколько раз константа данной кислоты больше константы гидроксония:
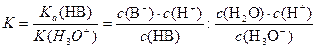
После преобразования получаем:
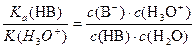
Константа отдачи протона гидроксонием непосредственно не определяется. Ее значение целесообразно принять равным 55,3. Это число совпадает с концентрацией растворителя H2O. После сокращения получаем
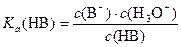
Константа Ka (HB) называется константой кислотности. Численно она совпадает с константой диссоциации Аррениуса, а математически показывает, во сколько раз константа данной кислоты отличается от константы гидроксония, то есть 55,3. При различных расчетах часто используется силовой показатель кислоты

Чем больше силовой показатель, тем слабее данная кислота. Константы кислотности и силовые показатели даются в таблицах в учебниках и справочниках. Обычно в таблице дается не только формула кислоты, но и сопряженного основания.
|
|
|
Принимая во внимание, что в растворе, содержащем только данную слабую кислоту НВ, c(H3O+) = c(B–), получим формулу для расчета концентрации ионов водорода (гидроксония) в растворе слабой кислоты:
 ;
;  ,
,
где c o(HB) – суммарная концентрация кислоты в протонированной и депротонированной форме. При наличии в растворе нескольких кислот эта формула не применима.
В случае сильной кислоты
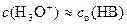 ;
; 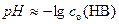
Проводя такие же рассуждения для равновесий в растворах оснований В, получим аналогичные формулы:
 В + H2O НВ+ + OH–
В + H2O НВ+ + OH–
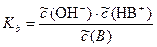
Константа Kb называется константой основности. Соответственно,
 – силовой показатель основания В.
– силовой показатель основания В.
Концентрация гидроксид-ионов в растворе слабого основания рассчитывается по формуле
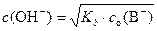
Между константой кислотности кислоты HB и константой основности ее сопряженного основания B– и их силовыми показателями имеется простая взаимосвязь:
Ka (HB)× Kb (B–) = Kw = 10–14
pKa (HB) + pKb (B–) = 14
По этим формулам рассчитываются значения Kb и pKb, и поэтому нет необходимости приводить их в справочных таблицах.
Очевидно, что между силой кислоты и основания, составляющих сопряженную пару, имеется обратно пропорциональная зависимость – чем сильнее кислота, тем слабее сопряженное основание.
Зная константы кислотности и основности, можно рассчитать константу равновесия протолитической реакции, протекающей в водном растворе:
 или
или 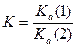
Рассмотрим реакцию
1 2
 CH3COOH + NH3 NH4+ + CH3COO–
CH3COOH + NH3 NH4+ + CH3COO–
K 1,8×10–5 5,6×10–10
K = 1,8×10–5/5,6×10–10 = 3,2×104 (степень превращения 99,5%, не зависит от начальных концентраций)
Можно рассмотреть шкалу кислот и оснований
Можно рассмотреть шкалу кислот и оснований
 |
С2Н5ОН Н2РО4- HClO3 H3O+
 Сила кислот увеличивается
Сила кислот увеличивается
 Сила сопряженных оснований увеличивается
Сила сопряженных оснований увеличивается
| |||
 |
С2Н5О- НРО42- ClO3- H2O
|
|
|
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 3278; Нарушение авторских прав?; Мы поможем в написании вашей работы!