
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Донорно-акцепторному, когда один из соединяющихся атомов предоставляет электронную пару, а другой — вакантную орбиталь, на которой она может разместиться
|
|
|
|
Обменному, когда каждый из соединяющихся атомов имеет на валентном уровне неспаренный электрон, который он предоставляет для образования общей электронной пары;
Ковалентная связь образуется парой или несколькими парами электронов, обобществляемых между двумя соседними атомами.
Ковалентная связь
Типы химических связей и их свойства.
Метод молекулярных орбиталей.
В этом методе молекулы рассматриваются как единое целое, а электроны, принадлежащие всей молекуле в целом. Состояние электронов описывается молекулярными орбиталями.
Химическая связь – это совокупность сил, удерживающих атомы или ионы в молекулах и кристаллах.
В зависимости от характера распределения электронной плотности относительно ядер различают следующие типы химических связей: ковалентная, ионная, металлическая и водородная.
Наиболее распространенный тип связи – ковалентная связь.
Под «общей электронной парой» подразумевается сгусток электронной плотности, образующийся между двумя атомами в результате перекрывания электронных облаков принадлежавших им неспаренных электронов.
Образования общей электронной пары может осуществляться по двум механизмам:
1) Пример обменного механизма:
Образование двухатомной молекулы хлороводорода. Атомы водорода и хлора имеют следующие электронные конфигурации:
1Н, 1S1 17Cl, 1S22S22p63S23p5
При этом валентные электроны распределяются по орбиталям следующим образом:
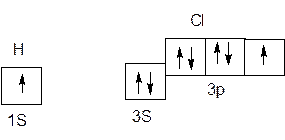
Таким образом, и у водорода, и у хлора имеется по одному неспаренному электрону. Наличие на внешних орбиталях как неспаренных, так и спаренных электронов, т. е. двух электронов с противоположно направленными спинами. Образование из атомов водорода и хлора молекул НС1 можно изобразить следующей схемой:
|
|
|
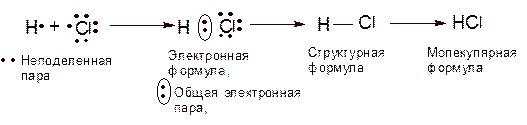
На схеме общая для обоих соединяющихся атомов электронная пары обозначена двумя точками между символами элементов. Электронные пары, не используемые атомами для образования связи, обозначены парами точек около символа соответствующего элемента; такие электронные пары называют неподеленными. Этот способ изображения электронного строения молекул называют электронными формулами.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1394; Нарушение авторских прав?; Мы поможем в написании вашей работы!